题目内容
15.下列关于物质的检验说法不正确的是( )| A. | 待检液加入氯化钡溶液有白色沉淀生成,再加入盐酸沉淀消失且产生无色无味的气体,则待检液中一定含有CO32- | |
| B. | 加入氯化钡溶液有白色沉淀生成,再加稀硝酸,沉淀不消失,一定含有SO42- | |
| C. | 将氢气在某气体中点燃,若产生苍白色火焰,则该气体为氯气 | |
| D. | 待检液加入NaOH溶液并加热,有能使湿润的红色石蕊试纸变蓝的气体生成,则原溶液中一定含有NH4+ |
分析 A.生成的无色无味的气体为二氧化碳,说明生成的沉淀为碳酸银,原溶液中一定含有碳酸根离子;
B.生成的白色沉淀可能为氯化银或硫酸钡,原溶液中可能含有银离子或亚硫酸根离子,不一定含有硫酸根离子;
C.氢气在氯气中燃烧,发出苍白色的火焰;
D.能使湿润的红色石蕊试纸变蓝的气体为氨气,则原溶液中一定含有铵根离子.
解答 解:A.待检液加入氯化钡溶液有白色沉淀生成,再加入盐酸沉淀消失且产生无色无味的气体,该气体为二氧化碳,生成的沉淀为碳酸钡,则待检液中一定含有CO32-,故A正确;
B.向一溶液中加入氯化钡溶液有白色沉淀生成,再加稀硝酸,沉淀不消失,生成的沉淀可能为氯化银或硫酸钡,原溶液中可能含有银离子或亚硫酸根离子,原溶液中不一定含有SO42-,故B错误;
C.氢气在氯气中点燃,产生苍白色火焰,说明该气体为氯气,故C正确;
D.铵根离子的检验方法:向待测液中,加入NaOH溶液并加热,产生能使湿润的红色石蕊试纸变蓝的气体生成,则原溶液中一定含有NH4+,故D正确;
故选B.
点评 本题考查了常见离子的检验方法,题目难度中等,明确常见离子的性质为解答关键,注意在检验离子存在时,需要排除干扰离子,确保检验方案的严密性.

练习册系列答案
 教学练新同步练习系列答案
教学练新同步练习系列答案 课前课后同步练习系列答案
课前课后同步练习系列答案 课堂小作业系列答案
课堂小作业系列答案 黄冈小状元口算速算练习册系列答案
黄冈小状元口算速算练习册系列答案 成功训练计划系列答案
成功训练计划系列答案 倍速训练法直通中考考点系列答案
倍速训练法直通中考考点系列答案
相关题目
15.将SO2气体通入CaCl2溶液,若要有白色沉淀产生,可加入的试剂是( )
| A. | 氯化钾溶液 | B. | 碳酸氢钙溶液 | C. | 氯水 | D. | 氢氧化钠溶液 |
3.根据表中的信息判断下列说法错误的是( )
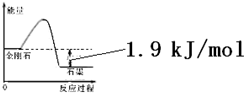
| 物质 | 外观 | 熔点 | 燃烧热/(kJ•mol-1) |
| 金刚石 | 无色,透明固体 | ? | 395.4 |
| 石墨 | 灰黑,不透明固体 | ? | 393.5 |

| A. | 由表中信息可得如右图所示的图象 | |
| B. | 由表中信息知C(石墨,s)=C(金刚石,s)△H=+1.9kJ/mol | |
| C. | 由表中信息可推知相同条件下金刚石的熔点低于石墨的熔点 | |
| D. | 表示石墨燃烧热的热化学方程式为C(石墨,s)+$\frac{1}{2}$O2(g)=CO(g)△H=-393.5kJ/mol |
20.下列化学用语正确的是( )
| A. | 硫酸铝的电离方程式:Al2(SO4)3═Al3++SO42- | |
| B. | 氯化钠的电子式: | |
| C. | 甲烷的结构简式:CH4 | |
| D. | 14C的原子结构示意图: |
7.对于0.1mol•L-1Na2CO3溶液,下列描述正确的是( )
| A. | 升高温度,溶液中c(OH-)降低 | B. | 加入少量NaOH固体,c(CO32-)增大 | ||
| C. | c(Na+)═2c(CO32-)+c(HCO3-)+c(H2CO3) | D. | c(Na+)+c(H+)═2c(CO32-)+2c(HCO3-)+c(OH-) |
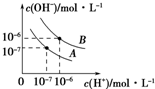 已知水在25℃和95℃时,其电离平衡曲线如图所示.
已知水在25℃和95℃时,其电离平衡曲线如图所示.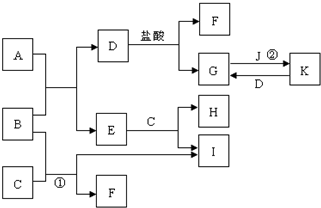 如图所示的是一些常见的单质、化合物之间的转化关系图,有些反应中的部分物质和反应条件被略去. A俗称“铁红”,B、D都是日常生活中常见的金属,且B元素是地壳中含量最多的金属元素,常温下,J为黄绿色气体,H为无色气体;C是一种碱,且其焰色反应时,透过蓝色钴玻璃可观察到紫色火焰.
如图所示的是一些常见的单质、化合物之间的转化关系图,有些反应中的部分物质和反应条件被略去. A俗称“铁红”,B、D都是日常生活中常见的金属,且B元素是地壳中含量最多的金属元素,常温下,J为黄绿色气体,H为无色气体;C是一种碱,且其焰色反应时,透过蓝色钴玻璃可观察到紫色火焰.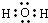 .
.