题目内容
20.下列化学用语正确的是( )| A. | 硫酸铝的电离方程式:Al2(SO4)3═Al3++SO42- | |
| B. | 氯化钠的电子式: | |
| C. | 甲烷的结构简式:CH4 | |
| D. | 14C的原子结构示意图: |
分析 A.该电离方程式不满足电荷守恒;
B.氯离子为阴离子,电子式中需要标出最外层电子数;
C.甲烷分子中含有4个碳氢键,据此判断其结构简式;
D.碳原子的核电荷数为6,不是8.
解答 解:A.硫酸铝为强电解质,其正确的电离方程式为Al2(SO4)3═2Al3++3SO42-,故A错误;
B.氯化钠为离子化合物,钠离子直接用离子符号表示,氯离子需要标出最外层电子及所带电荷,氯化钠正确的电子式为 ,故B错误;
,故B错误;
C.甲烷为含有1个碳的烷烃,其结构简式为CH4,故C正确;
D.14C的核电荷数=核外电子总数=6,其正确的原子结构示意图为 ,故D错误;
,故D错误;
故选C.
点评 本题考查了常见化学用语的表示方法判断,题目难度中等,涉及原子结构示意图、电子数、电离方程式、结构简式等知识,明确常见化学用语的概念及书写原则为解答关键.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
20.在酸性溶液中,能大量共存的离子是( )
| A. | Al3+、Fe2+、Cl-、SO42- | B. | Mg2+、Fe3+、NO3-、SCN- | ||
| C. | K+、Na+、Cl-、HCO3- | D. | Na+、Ba2+、NO3-、SO42- |
8.在标准状况下,若vL甲烷中含有的氢原子个数为n,则阿伏加德罗常数可表示为( )
| A. | $\frac{22.4}{Vn}$ | B. | $\frac{22.4n}{V}$ | C. | $\frac{Vn}{5.6}$ | D. | $\frac{5.6n}{V}$ |
15.下列关于物质的检验说法不正确的是( )
| A. | 待检液加入氯化钡溶液有白色沉淀生成,再加入盐酸沉淀消失且产生无色无味的气体,则待检液中一定含有CO32- | |
| B. | 加入氯化钡溶液有白色沉淀生成,再加稀硝酸,沉淀不消失,一定含有SO42- | |
| C. | 将氢气在某气体中点燃,若产生苍白色火焰,则该气体为氯气 | |
| D. | 待检液加入NaOH溶液并加热,有能使湿润的红色石蕊试纸变蓝的气体生成,则原溶液中一定含有NH4+ |
5.下列不属于天然高分子化合物的是( )
| A. | 淀粉 | B. | 纤维素 | C. | 油脂 | D. | 蛋白质 |
12.下列关于碳酸钠和碳酸氢钠的比较中,正确的是( )
| A. | 热稳定性:Na2CO3<NaHCO3 | |
| B. | 碱性:Na2CO3<NaHCO3 | |
| C. | 水中的溶解度:Na2CO3>NaHCO3 | |
| D. | 与足量的盐酸反应产生的气体的体积:Na2CO3<NaHCO3 |
10.下列有关钠和镁的说法中,不正确的是( )
| A. | 电解饱和食盐水可以得到氯气 | |
| B. | 金属钠在高温下能将TiCl4中的钛置换出来 | |
| C. | 金属镁燃烧后会发出耀眼的白光,因此常用来制造信号弹和焰火 | |
| D. | 金属镁着火,可用二氧化碳灭火 |
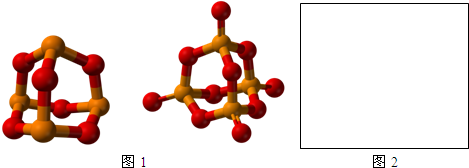
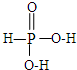 ,写出H3PO2与足量氢氧化钠溶液反应的化学方程式NaOH+H3PO2=Na H2PO2+H2O.磷的三种含氧酸H3PO2、H3PO3、H3PO4的酸性强弱顺序为H3PO2<H3PO3<H3PO4,其原因是H3PO2、H3PO3、H3PO4中磷元素的化合价依次为+1,+3和+5价,中心磷原子的正电荷依次升高,导致P-O-H中O的电子更易向P偏移,因而H3PO2、H3PO3、H3PO4越易电离出氢离子,酸性越来越强.
,写出H3PO2与足量氢氧化钠溶液反应的化学方程式NaOH+H3PO2=Na H2PO2+H2O.磷的三种含氧酸H3PO2、H3PO3、H3PO4的酸性强弱顺序为H3PO2<H3PO3<H3PO4,其原因是H3PO2、H3PO3、H3PO4中磷元素的化合价依次为+1,+3和+5价,中心磷原子的正电荷依次升高,导致P-O-H中O的电子更易向P偏移,因而H3PO2、H3PO3、H3PO4越易电离出氢离子,酸性越来越强.