题目内容
11.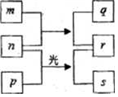 短周期元素W、X、Y、Z的原子序数依次増加.m、p、r是由这些元素组成的二元化合物,n是元素Z的单质,通常为黄绿色气体,q的水溶液具有漂白性,0.01mol•L-1r 溶液的pH为2,s通常是难溶于水的液态混合物.上述物质的转化关系如图所示.下列说法正确的是( )
短周期元素W、X、Y、Z的原子序数依次増加.m、p、r是由这些元素组成的二元化合物,n是元素Z的单质,通常为黄绿色气体,q的水溶液具有漂白性,0.01mol•L-1r 溶液的pH为2,s通常是难溶于水的液态混合物.上述物质的转化关系如图所示.下列说法正确的是( )| A. | 原子半径的大小W<X<Y | B. | 元素的非金属性Z>Y>X | ||
| C. | W、X形成的1:1型的化合物有很多种 | D. | X的最高价氧化物的水化物为强酸 |
分析 短周期元素W、X、Y、Z的原子序数依次增加.m、p、r是由这些元素组成的二元化合物,n是元素Z的单质,通常为黄绿色气体,则n为Cl2,Z为Cl,氯气与p在光照条件下生成r与s,0.01mol•L-1r溶液的pH为2,则r为HCl,s通常是难溶于水的混合物,则p为CH4等,氯气与m反应生成HCl与q,q的水溶液具有漂白性,则m为H2O,q为HClO,结合原子序数可知W为H元素,X为C元素,Y为O元素,结合元素周期律解答.
解答 解:由上述分析可知,W为H元素,X为C元素,Y为O元素,Z为Cl,
A.电子层越多,原子半径越大,同周期自左而右原子半径减小,故原子半径W(H)<Y(O)<X(C),故A错误;
B.氯的氧化物中氧元素表现负化合价,氧元素非金属性比氯的强,高氯酸为强酸,碳酸为弱酸,氯元素非金属性比碳的强,故非金属性Y(O)>Z(Cl)>X(C),故B错误;
C.W、X形成的1:1型的化合物有乙炔、苯、苯乙烯等,故C正确;
D.X的最高价氧化物的水化物为碳酸,碳酸属于弱酸,故D错误;
故选C.
点评 本题考查无机物的推断,为高频考点,把握n为氯气、r为盐酸、图中转化为解答的关键,侧重分析与应用能力的考查,注意元素化合物知识及规律性知识的应用,氯气与水反应生成盐酸和HClO为推断的突破口,题目难度不大.

练习册系列答案
 怎样学好牛津英语系列答案
怎样学好牛津英语系列答案
相关题目
1.如图是部分短周期元素原子(用字母表示)最外层电子数与原子序数的关系.下列说法正确的是( ) 

| A. | X和R在同一周期 | B. | 原子半径:W>R>X | ||
| C. | 气态氢化物的稳定性:Y<X | D. | 简单离子半径:Z+<Y-<X2- |
19.下列关于有机物的说法错误的是( )
| A. | 可用饱和碳酸钠溶液鉴别乙酸、乙醇和乙酸乙酯 | |
| B. | 乙烯和氯乙烯都可以通过聚合反应得到高分子材料 | |
| C. | 纤维素不属于营养物质,对人体没有任何作用 | |
| D. | C2H6O和C4H10都有2种同分异构体 |
6.设NA为阿伏加德罗常数的值,下列说法中正确的是( )
| A. | 某密闭容器中盛有0.2molSO2和0.1molO2,一定条件下充分反应,生成SO3分子数为0.2NA | |
| B. | 一定条件下,2.3g Na与O2完全反应生成3.6g产物时失去的电子数为0.1 NA | |
| C. | 25℃时,0.1 mol•L─1Na2S溶液中含有Na+的数目为0.2 NA | |
| D. | 将1mL 5.68 mol•L─1的FeCl3饱和溶液制成胶体,可得到0.00568 NA个Fe(OH)3胶粒 |
1.下列离子方程式的书写正确的是( )
| A. | 实验室用大理石和稀盐酸制取CO2:2H++CO32-═CO2↑+H2O | |
| B. | NaHCO3溶液与NaOH溶液反应:OH-+HCO3-═CO32-+H2O | |
| C. | 向AlCl3溶液中加入过量的NaOH溶液:Al3++3OH-═Al(OH)3↓ | |
| D. | 钠和冷水反应 Na+2H2O═Na++2OH-+H2↑ |
8.可逆反应2SO2(g)+O2(g)?2SO3(g),下表中的数据为不同温度不同压强下的SO2转化率,由此判断下列图象错误的是( )
| 温度 | Pl(Mpa) | P2(Mpa) |
| 400℃ | 99.6 | 99.7 |
| 500℃ | 96.9 | 97.8 |
| A. |  | B. |  | C. | 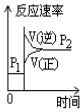 | D. |  |
5.下列6个装置中,属于原电池的装置有(F中,盐桥能使离子透过一一起导电的作用)( )

| A. | 2个 | B. | 3个 | C. | 4个 | D. | 5个 |
4. 25℃时,用 0.10mol•L-1的氨水滴定10.0mL a mol•L-1的盐酸,溶液的pH与氨水体积(V)的关系如图所示.已知:N点溶液中存在:c(Cl-)=c(NH4+)+c(NH3•H2O).下列说法不正确的是( )
25℃时,用 0.10mol•L-1的氨水滴定10.0mL a mol•L-1的盐酸,溶液的pH与氨水体积(V)的关系如图所示.已知:N点溶液中存在:c(Cl-)=c(NH4+)+c(NH3•H2O).下列说法不正确的是( )
 25℃时,用 0.10mol•L-1的氨水滴定10.0mL a mol•L-1的盐酸,溶液的pH与氨水体积(V)的关系如图所示.已知:N点溶液中存在:c(Cl-)=c(NH4+)+c(NH3•H2O).下列说法不正确的是( )
25℃时,用 0.10mol•L-1的氨水滴定10.0mL a mol•L-1的盐酸,溶液的pH与氨水体积(V)的关系如图所示.已知:N点溶液中存在:c(Cl-)=c(NH4+)+c(NH3•H2O).下列说法不正确的是( )| A. | a=0.10 | |
| B. | N、P两点溶液中水的电离程度:N<P | |
| C. | M、N两点溶液中NH4+的物质的量之比大于1:2 | |
| D. | Q 点溶液中存在:2c(OH-)-2c(H+)=c(NH4+)-c(NH3•H2O) |
 )是一种常见的抗病毒药剂,其合成路线如图:
)是一种常见的抗病毒药剂,其合成路线如图:
 .
. $\stackrel{反应1}{→}$X$\stackrel{反应2}{→}$Y$\stackrel{Br_{2}/CCl_{4}}{→}$Z$\stackrel{反应3}{→}$A
$\stackrel{反应1}{→}$X$\stackrel{反应2}{→}$Y$\stackrel{Br_{2}/CCl_{4}}{→}$Z$\stackrel{反应3}{→}$A .
.