题目内容
5.下列6个装置中,属于原电池的装置有(F中,盐桥能使离子透过一一起导电的作用)( )
| A. | 2个 | B. | 3个 | C. | 4个 | D. | 5个 |
分析 原电池形成的条件,有两个活性不同的电极,形成闭合回路,有电解质溶液,对应常温下自动发生的氧化还原反应,以此判断.
解答 解:A.装置中不能放松自发进行的氧化还原反应,故A不能形成原电池;
B.酒精是非电解质不能导电,不能形成原电池;
C.铁做负极失电子,溶液中铜离子在铜电极上析出铜,形成原电池反应;
D.铁和碳在稀硫酸中形成原电池,铁做负极失电子发生氧化反应,碳电极上氢离子得到电子生成氢气;
E.铁做负极失电子发生氧化反应,碳做正极在稀硫酸溶液中形成原电池反应,溶液中氢离子得到电子生成氢气;
F.装置中锌做负极失电子发生氧化反应,铜做正极溶液中铜离子得到电子发生还原反应,中间盐桥依据电解质溶液电中性形成闭合回路;
故形成原电池反应的有CDEF,
故选C.
点评 本题考查原电池原理,明确原电池构成条件是解答本题的关键,注意结合氧化还原反应来分析,题目难度不大.

练习册系列答案
相关题目
11.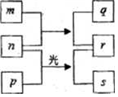 短周期元素W、X、Y、Z的原子序数依次増加.m、p、r是由这些元素组成的二元化合物,n是元素Z的单质,通常为黄绿色气体,q的水溶液具有漂白性,0.01mol•L-1r 溶液的pH为2,s通常是难溶于水的液态混合物.上述物质的转化关系如图所示.下列说法正确的是( )
短周期元素W、X、Y、Z的原子序数依次増加.m、p、r是由这些元素组成的二元化合物,n是元素Z的单质,通常为黄绿色气体,q的水溶液具有漂白性,0.01mol•L-1r 溶液的pH为2,s通常是难溶于水的液态混合物.上述物质的转化关系如图所示.下列说法正确的是( )
 短周期元素W、X、Y、Z的原子序数依次増加.m、p、r是由这些元素组成的二元化合物,n是元素Z的单质,通常为黄绿色气体,q的水溶液具有漂白性,0.01mol•L-1r 溶液的pH为2,s通常是难溶于水的液态混合物.上述物质的转化关系如图所示.下列说法正确的是( )
短周期元素W、X、Y、Z的原子序数依次増加.m、p、r是由这些元素组成的二元化合物,n是元素Z的单质,通常为黄绿色气体,q的水溶液具有漂白性,0.01mol•L-1r 溶液的pH为2,s通常是难溶于水的液态混合物.上述物质的转化关系如图所示.下列说法正确的是( )| A. | 原子半径的大小W<X<Y | B. | 元素的非金属性Z>Y>X | ||
| C. | W、X形成的1:1型的化合物有很多种 | D. | X的最高价氧化物的水化物为强酸 |
13.两种短周期元素组成的化合物中,原子个数比为1?:3,若两种元素的原子序数分别为a和b,则a和b的关系可能是( )
①a=b+6
②a+b=8
③a+b=30
④a=b+8.
①a=b+6
②a+b=8
③a+b=30
④a=b+8.
| A. | ①②③ | B. | ①②④ | C. | ②③④ | D. | ①②③④ |
20.下列说法正确的是( )
| A. | ⅠA族元素的金属性比ⅡA族元素的金属性强 | |
| B. | ⅥA族元素的氢化物中,稳定性最好的其沸点也最高 | |
| C. | MgCl2属于离子化合物,其中既含有离子键又含有共价键 | |
| D. | 第三周期元素的离子半径从左到右逐渐减小 |
10.在催化剂存在下发生反应:4NH3+5O2 $→_{△}^{Pt}$4NO+6H2O完成下列计算10mol NH3和10mol O2反应生成8mol NO,过量的氨溶于产物水中成为氨水,则该氨水中氨的质量分数为( )
| A. | 13.6% | B. | 15.7% | C. | 28% | D. | 32.4% |
17.下列反应中,属于取代反应的是( )
| A. | CH2=CH2+H2O$→_{△}^{催化剂}$CH3CH2OH | |
| B. | CH3CH2Br+NaOH$→_{△}^{水}$CH3CH2OH+NaBr | |
| C. | 2CH3CHO+O2$→_{△}^{催化剂}$2CH3COOH | |
| D. | 2CH2=CH2+O2$→_{△}^{催化剂}$ |
14.下列有关叙述错误的是( )
| A. | 推广使用无磷洗衣粉主要是为了防止水体富营养化 | |
| B. | “地沟油”危害健康,主要是人体所必需的维生素E、脂肪酸油脂已经被破坏 | |
| C. | 2011年诺贝尔化学奖授予以色列科学家达尼埃尔•谢赫特曼,以表彰他发现了准晶体,它与晶体相比具有晶体所不允许的宏观对称性 | |
| D. | 合金的某些性能与组成它的纯金属的某些性能相同 |