题目内容
8.可逆反应2SO2(g)+O2(g)?2SO3(g),下表中的数据为不同温度不同压强下的SO2转化率,由此判断下列图象错误的是( )| 温度 | Pl(Mpa) | P2(Mpa) |
| 400℃ | 99.6 | 99.7 |
| 500℃ | 96.9 | 97.8 |
| A. |  | B. |  | C. | 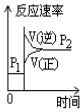 | D. |  |
分析 由表中数据可知,在相同压强下,升高温度,A的转化率降低,说明升高温度平衡向逆反应方向移动,则正反应为放热反应,在相同温度下,增大压强,A的转化率增大,说明平衡向正反应方向移动,对比图象可解答该题.
解答 解:A.升高温度,平衡逆向移动,A的转化率降低,与表中数据吻合,故A正确;
B.升高温度,平衡向逆反应方向移动,C的百分含量降低,增大压强,平衡向正反应方向移动,C的百分含量增大,与表中数据吻合,故B正确;
C.增大压强,反应速率增大,正反应速率大于逆反应速率平衡向正反应方向移动,图象与表中数据不吻合,故C错误;
D.升高,反应速率增大,平衡向逆反应方向移动,逆反应速率大于正反应速率,与表中数据吻合,故D正确.
故选C.
点评 本题考查温度温度、压强对平衡移动的影响,为高频考点,侧重考查学生的分析能力,题目难度中等,注意分析表中数据以及图象的曲线的变化,学习中注意加强该方面能力的培养.

练习册系列答案
相关题目
13.下列有关有机物说法不正确的是( )
| A. | 四苯基乙烯( )中所有碳原子一定处于同一平面 )中所有碳原子一定处于同一平面 | |
| B. | CH3CH(-OH)CH2COOH系统命名法命名:3-羟基丁酸 | |
| C. | 1 mol  分别与足量的Na、NaOH溶液、NaHCO3溶液反应,消耗这三种物质的物质的量分别为3 mol、4 mol、1 mol 分别与足量的Na、NaOH溶液、NaHCO3溶液反应,消耗这三种物质的物质的量分别为3 mol、4 mol、1 mol | |
| D. | 在一定条件下,苯与液溴、浓硝酸生成溴苯、硝基苯的反应都属于取代反应 |
14.短周期主族元素X、Y、Z、W、Q的原子序数依次增大,X的质子数为1,Y的最外层电子数是内层电子数的2倍,Z的原子序数等于X和Y的原子序数之和,W 在自然界中既有游离态又有化合态,Q是短周期中原子半径最大的元素.下列叙述正确的是( )
| A. | Y4X10分子中,极性键和非极性键的个数比为10:4 | |
| B. | Z和W形成的多种化合物中只有一种能与水反应 | |
| C. | 25℃时,等浓度的Z和Q的最高价氧化物对应水化物的水溶液中,水电离的c(H+)相等 | |
| D. | 25℃时,Z、W、X按原子个数比2:3:4形成的化合物的水溶液的pH=7 |
11.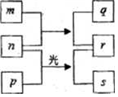 短周期元素W、X、Y、Z的原子序数依次増加.m、p、r是由这些元素组成的二元化合物,n是元素Z的单质,通常为黄绿色气体,q的水溶液具有漂白性,0.01mol•L-1r 溶液的pH为2,s通常是难溶于水的液态混合物.上述物质的转化关系如图所示.下列说法正确的是( )
短周期元素W、X、Y、Z的原子序数依次増加.m、p、r是由这些元素组成的二元化合物,n是元素Z的单质,通常为黄绿色气体,q的水溶液具有漂白性,0.01mol•L-1r 溶液的pH为2,s通常是难溶于水的液态混合物.上述物质的转化关系如图所示.下列说法正确的是( )
 短周期元素W、X、Y、Z的原子序数依次増加.m、p、r是由这些元素组成的二元化合物,n是元素Z的单质,通常为黄绿色气体,q的水溶液具有漂白性,0.01mol•L-1r 溶液的pH为2,s通常是难溶于水的液态混合物.上述物质的转化关系如图所示.下列说法正确的是( )
短周期元素W、X、Y、Z的原子序数依次増加.m、p、r是由这些元素组成的二元化合物,n是元素Z的单质,通常为黄绿色气体,q的水溶液具有漂白性,0.01mol•L-1r 溶液的pH为2,s通常是难溶于水的液态混合物.上述物质的转化关系如图所示.下列说法正确的是( )| A. | 原子半径的大小W<X<Y | B. | 元素的非金属性Z>Y>X | ||
| C. | W、X形成的1:1型的化合物有很多种 | D. | X的最高价氧化物的水化物为强酸 |
3.为研究哈伯法合成氨反应,T℃时,在容积为2L恒容容器中通入4mol N2和12mol H2,反应如下:
N2(g)+3H2(g) $?_{高温高压}^{催化剂}$2NH3(g)△H=-92kJ/mol
相关键能数据如下:
若25min时反应达到平衡,各物质浓度随时间变化曲线如图中甲、乙、丙.回答下列问题:

(1)0-25min内,反应的平均速率v(H2)为0.12mol/(L•min);表中x=391.
(2)T℃时,该反应的平衡常数K=$\frac{4}{27}$L2/mol2(用最简分数表达).
(3)T℃时,若起始充入8molN2和24molH2,则反应刚达到平衡时,表示c(H2)在图中相应的点为B(填字母).
(4)以煤为主要原料的合成氨工业中,原料气氢气常用下述方法获得:
①C(s)+H2O(g)?CO(g)+H2(g)△H1
②CO(g)+H2O(g)?CO2(g)+H2(g)△H2
若已知CO和H2的燃烧热分别为283KJ•mol-1和285.8KJ•mol-1
H2O(g)=H2O(l)△H=-44kJ/mol,则△H2=-41.2kJ/mol.
(5)氨气是生产硝酸的重要原料,其过程如图1:

写出步骤I的化学方程式:4NH3+5O2$\frac{\underline{催化剂}}{△}$4NO+6H2O
(6)图2是科学家提出的利用电解法常温常压下由氮气、氢气合成氨的示意图:由图可知,把电极B是电解池的阳极(填“阴极”或“阳极”);把电极A上的电极反应式为N2+6e-+6H+=2NH3.
N2(g)+3H2(g) $?_{高温高压}^{催化剂}$2NH3(g)△H=-92kJ/mol
相关键能数据如下:
| N≡N | H-H | N-H | |
| 键能数据(KJ/mol) | 946 | 436 | x |

(1)0-25min内,反应的平均速率v(H2)为0.12mol/(L•min);表中x=391.
(2)T℃时,该反应的平衡常数K=$\frac{4}{27}$L2/mol2(用最简分数表达).
(3)T℃时,若起始充入8molN2和24molH2,则反应刚达到平衡时,表示c(H2)在图中相应的点为B(填字母).
(4)以煤为主要原料的合成氨工业中,原料气氢气常用下述方法获得:
①C(s)+H2O(g)?CO(g)+H2(g)△H1
②CO(g)+H2O(g)?CO2(g)+H2(g)△H2
若已知CO和H2的燃烧热分别为283KJ•mol-1和285.8KJ•mol-1
H2O(g)=H2O(l)△H=-44kJ/mol,则△H2=-41.2kJ/mol.
(5)氨气是生产硝酸的重要原料,其过程如图1:

写出步骤I的化学方程式:4NH3+5O2$\frac{\underline{催化剂}}{△}$4NO+6H2O
(6)图2是科学家提出的利用电解法常温常压下由氮气、氢气合成氨的示意图:由图可知,把电极B是电解池的阳极(填“阴极”或“阳极”);把电极A上的电极反应式为N2+6e-+6H+=2NH3.
13.两种短周期元素组成的化合物中,原子个数比为1?:3,若两种元素的原子序数分别为a和b,则a和b的关系可能是( )
①a=b+6
②a+b=8
③a+b=30
④a=b+8.
①a=b+6
②a+b=8
③a+b=30
④a=b+8.
| A. | ①②③ | B. | ①②④ | C. | ②③④ | D. | ①②③④ |
20.下列说法正确的是( )
| A. | ⅠA族元素的金属性比ⅡA族元素的金属性强 | |
| B. | ⅥA族元素的氢化物中,稳定性最好的其沸点也最高 | |
| C. | MgCl2属于离子化合物,其中既含有离子键又含有共价键 | |
| D. | 第三周期元素的离子半径从左到右逐渐减小 |
17.下列反应中,属于取代反应的是( )
| A. | CH2=CH2+H2O$→_{△}^{催化剂}$CH3CH2OH | |
| B. | CH3CH2Br+NaOH$→_{△}^{水}$CH3CH2OH+NaBr | |
| C. | 2CH3CHO+O2$→_{△}^{催化剂}$2CH3COOH | |
| D. | 2CH2=CH2+O2$→_{△}^{催化剂}$ |
16.某羧酸酯的分子式为C18H26O5,1mol该酯是由1mol羧酸和2mol乙醇完全反应生成,该羧酸的分子式为( )
| A. | C14H10O5 | B. | C14H16O4 | C. | C14H22O5 | D. | C14H18O5 |