题目内容
1.下列离子方程式的书写正确的是( )| A. | 实验室用大理石和稀盐酸制取CO2:2H++CO32-═CO2↑+H2O | |
| B. | NaHCO3溶液与NaOH溶液反应:OH-+HCO3-═CO32-+H2O | |
| C. | 向AlCl3溶液中加入过量的NaOH溶液:Al3++3OH-═Al(OH)3↓ | |
| D. | 钠和冷水反应 Na+2H2O═Na++2OH-+H2↑ |
分析 A.大理石的主要成分为碳酸钙,碳酸钙不能拆开;
B.NaHCO3溶液与NaOH溶液反应生成碳酸钠和水;
C.氢氧化铝是两性氢氧化物溶于过量的氢氧化钠溶液中;
D.离子方程式中电荷不守恒.
解答 解:A.碳酸钙不能拆开,正确的离子方程式为:CaCO3+2H+=Ca2++H2O+CO2↑,故A错误;
B.NaHCO3溶液与NaOH溶液反应生成溶于水完全电离的碳酸钠:OH-+HCO3-═CO32-+H2O,故B正确;
C.向AlCl3溶液中加入过量的NaOH溶液生成偏铝酸钠、氯化钠和水:Al3++4OH-═AlO2-+2H2O,故C错误;
D.钠和冷水反应的离子方程式为:2Na+2H2O═2Na++2OH-+H2↑,故D错误;
故选B.
点评 本题考查了离子方程式的书写判断,为高考的高频题,题目难度不大,注意掌握离子方程式正误判断常用方法:检查反应物、生成物是否正确,检查各物质拆分是否正确,如难溶物、弱电解质等需要保留化学式,检查是否符合守恒关系(如:质量守恒和电荷守恒等)、检查是否符合原化学方程式等.

练习册系列答案
相关题目
6.下列有关化学用语使用正确的是( )
| A. | 硫原子的原子结构示意图: | |
| B. | 原子核内有10个中子的氧原子:${\;}_{8}^{18}$O | |
| C. | NH4Cl的电子式: | |
| D. | 用电子式表示氯化氢分子的形成过程: |
7.下列实验所用试剂、现象和结论均正确的是( )
| 序号 | 相关实验 | 试剂 | 现象和结论 |
| ① | 鉴别K2CO3和Na2SO4 | 稀硫酸、澄清石灰水 | 产生使澄清石灰水变浑浊的无色无味气体的是K2CO3 |
| ② | 鉴别NO2和Br2蒸汽 | 湿润的淀粉KI试纸 | 试纸变蓝色的是Br2蒸汽 |
| ③ | 鉴别葡萄糖和蔗糖 | 银氨溶液 | 有银镜产生的是葡萄糖 |
| ④ | 鉴别AlCl3溶液和MgCl2溶液 | 氨水 | 先产生白色沉淀,然后沉淀又消失的是AlCl3溶液 |
| A. | ①③ | B. | ①② | C. | ②④ | D. | ②③ |
4.恒温下向体积为5L的恒容密闭容器中通入2mol A气体和1mol B气体,发生如下反应:2A(g)+B(g)?x C(g),2min时反应达到平衡状态,此时A的转化率和C的体积分数都是25%.则能作为该可逆反应到达平衡的标志是( )
| A. | 混合气体平均相对分子质量保持一定 | |
| B. | 单位时间内每生成3mol C的同时,生成1 mol B | |
| C. | 容器内气体密度恒定不变 | |
| D. | 反应前后容器内总压强恒定不变 |
11.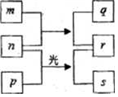 短周期元素W、X、Y、Z的原子序数依次増加.m、p、r是由这些元素组成的二元化合物,n是元素Z的单质,通常为黄绿色气体,q的水溶液具有漂白性,0.01mol•L-1r 溶液的pH为2,s通常是难溶于水的液态混合物.上述物质的转化关系如图所示.下列说法正确的是( )
短周期元素W、X、Y、Z的原子序数依次増加.m、p、r是由这些元素组成的二元化合物,n是元素Z的单质,通常为黄绿色气体,q的水溶液具有漂白性,0.01mol•L-1r 溶液的pH为2,s通常是难溶于水的液态混合物.上述物质的转化关系如图所示.下列说法正确的是( )
 短周期元素W、X、Y、Z的原子序数依次増加.m、p、r是由这些元素组成的二元化合物,n是元素Z的单质,通常为黄绿色气体,q的水溶液具有漂白性,0.01mol•L-1r 溶液的pH为2,s通常是难溶于水的液态混合物.上述物质的转化关系如图所示.下列说法正确的是( )
短周期元素W、X、Y、Z的原子序数依次増加.m、p、r是由这些元素组成的二元化合物,n是元素Z的单质,通常为黄绿色气体,q的水溶液具有漂白性,0.01mol•L-1r 溶液的pH为2,s通常是难溶于水的液态混合物.上述物质的转化关系如图所示.下列说法正确的是( )| A. | 原子半径的大小W<X<Y | B. | 元素的非金属性Z>Y>X | ||
| C. | W、X形成的1:1型的化合物有很多种 | D. | X的最高价氧化物的水化物为强酸 |
6.化学与日常生活密切相关,下列说法错误的是( )
| A. | “春蚕到死丝方尽,蜡炬成灰泪始干”中“丝”和“泪”分别是蛋白质和高级烃 | |
| B. | 可用  和HCHO为原料合成 和HCHO为原料合成 | |
| C. | 漂白粉因主要成分是CaCl2故暴露在空气中不易变质 | |
| D. | 按照分散质和分散剂所处状态的不同可以把分散系分为9种类型 |
13.两种短周期元素组成的化合物中,原子个数比为1?:3,若两种元素的原子序数分别为a和b,则a和b的关系可能是( )
①a=b+6
②a+b=8
③a+b=30
④a=b+8.
①a=b+6
②a+b=8
③a+b=30
④a=b+8.
| A. | ①②③ | B. | ①②④ | C. | ②③④ | D. | ①②③④ |
 气态烃A燃烧的温度特别高,可用来焊接金属和切割金属且A中碳、氢元素的质量比为12:1.已知B不与Na发生反应,D和E都含有羧基,请回答:
气态烃A燃烧的温度特别高,可用来焊接金属和切割金属且A中碳、氢元素的质量比为12:1.已知B不与Na发生反应,D和E都含有羧基,请回答: .
.