题目内容
4. 25℃时,用 0.10mol•L-1的氨水滴定10.0mL a mol•L-1的盐酸,溶液的pH与氨水体积(V)的关系如图所示.已知:N点溶液中存在:c(Cl-)=c(NH4+)+c(NH3•H2O).下列说法不正确的是( )
25℃时,用 0.10mol•L-1的氨水滴定10.0mL a mol•L-1的盐酸,溶液的pH与氨水体积(V)的关系如图所示.已知:N点溶液中存在:c(Cl-)=c(NH4+)+c(NH3•H2O).下列说法不正确的是( )| A. | a=0.10 | |
| B. | N、P两点溶液中水的电离程度:N<P | |
| C. | M、N两点溶液中NH4+的物质的量之比大于1:2 | |
| D. | Q 点溶液中存在:2c(OH-)-2c(H+)=c(NH4+)-c(NH3•H2O) |
分析 用 0.10mol/L的氨水滴定10.0mL a mol/L的盐酸,N点溶液存在:c(Cl-)=c(NH4+)+c(NH3•H2O),这是NH4Cl的物料守恒式,结合图象和溶液中的物料守恒,电荷守恒,质子守恒分析判断.
解答 解:A.用 0.10mol/L的氨水滴定10.0mL a mol/L的盐酸,N点溶液存在:c(Cl-)=c(NH4+)+c(NH3•H2O),这是NH4Cl的物料守恒式,表明N点恰好生成NH4Cl,为滴定终点,此时消耗氨水的体积为10.0mL,则a=0.10,故A正确;
B.N点恰好生成NH4Cl,水解促进水的电离,P点时存在过量的氨水,抑制水的电离,则N、P两点溶液中水的电离程度:N>P,故B错误;
C.M点时加入的氨水的体积为5.0mL,则溶液中起始时存在c(NH4Cl)=c(HCl),由于有HCl的存在,抑制NH4Cl的水解,N点时达到滴定终点,此时溶液中恰好生成NH4Cl,若不考虑水解,M、N两点溶液中NH4+的物质的量之比等于1:2,由于M点处NH4Cl被抑制,N点处NH4Cl水解不受抑制,则M、N两点溶液中NH4+的物质的量之比大于1:2,故C正确;
D.Q点时加入氨水的体积为20.0mL,溶液中起始时存在c(NH4Cl):c(NH3•H2O)=1:1,由质子守恒,c(NH3•H2O)+2c(OH-)=c(NH4+)+2c(H+),即2c(OH-)-2c(H+)=c(NH4+)-c(NH3•H2O),故D正确.
故选B.
点评 本题考查酸碱滴定原理,结合图象分析,牢牢把握守恒思想是解题的关键,本题的突破口就是题干中的物料守恒式,难度中等.

练习册系列答案
 新课标阶梯阅读训练系列答案
新课标阶梯阅读训练系列答案
相关题目
11.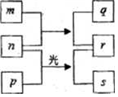 短周期元素W、X、Y、Z的原子序数依次増加.m、p、r是由这些元素组成的二元化合物,n是元素Z的单质,通常为黄绿色气体,q的水溶液具有漂白性,0.01mol•L-1r 溶液的pH为2,s通常是难溶于水的液态混合物.上述物质的转化关系如图所示.下列说法正确的是( )
短周期元素W、X、Y、Z的原子序数依次増加.m、p、r是由这些元素组成的二元化合物,n是元素Z的单质,通常为黄绿色气体,q的水溶液具有漂白性,0.01mol•L-1r 溶液的pH为2,s通常是难溶于水的液态混合物.上述物质的转化关系如图所示.下列说法正确的是( )
 短周期元素W、X、Y、Z的原子序数依次増加.m、p、r是由这些元素组成的二元化合物,n是元素Z的单质,通常为黄绿色气体,q的水溶液具有漂白性,0.01mol•L-1r 溶液的pH为2,s通常是难溶于水的液态混合物.上述物质的转化关系如图所示.下列说法正确的是( )
短周期元素W、X、Y、Z的原子序数依次増加.m、p、r是由这些元素组成的二元化合物,n是元素Z的单质,通常为黄绿色气体,q的水溶液具有漂白性,0.01mol•L-1r 溶液的pH为2,s通常是难溶于水的液态混合物.上述物质的转化关系如图所示.下列说法正确的是( )| A. | 原子半径的大小W<X<Y | B. | 元素的非金属性Z>Y>X | ||
| C. | W、X形成的1:1型的化合物有很多种 | D. | X的最高价氧化物的水化物为强酸 |
17.下列反应中,属于取代反应的是( )
| A. | CH2=CH2+H2O$→_{△}^{催化剂}$CH3CH2OH | |
| B. | CH3CH2Br+NaOH$→_{△}^{水}$CH3CH2OH+NaBr | |
| C. | 2CH3CHO+O2$→_{△}^{催化剂}$2CH3COOH | |
| D. | 2CH2=CH2+O2$→_{△}^{催化剂}$ |
14.下列有关叙述错误的是( )
| A. | 推广使用无磷洗衣粉主要是为了防止水体富营养化 | |
| B. | “地沟油”危害健康,主要是人体所必需的维生素E、脂肪酸油脂已经被破坏 | |
| C. | 2011年诺贝尔化学奖授予以色列科学家达尼埃尔•谢赫特曼,以表彰他发现了准晶体,它与晶体相比具有晶体所不允许的宏观对称性 | |
| D. | 合金的某些性能与组成它的纯金属的某些性能相同 |
1.用下列实验方案及所选玻璃仪器(非玻璃仪器任选>就能实现相应实验目的是( )
| 实验目的 | 实验方案 | 所选玻璃仪器 | |
| A | 除去KNO3中少量NaCl | 将混合物制成热的饱和溶液,冷却结晶,过滤 | 酒精灯、烧杯、玻璃棒 |
| B | 海带提碘 | 将海带剪碎,加蒸馏水浸泡,取滤液加稀硫酸和H2O2 | 试管、胶头滴管、烧杯、漏斗 |
| C | 测定饱和NaClO溶液、CH3COONa溶液的pH值 | 分别蘸取两种溶液滴在pH试纸上,颜色稳定后与标准比色卡对照 | 玻璃捧、玻璃片 |
| D | 配制480ml0.5mol/LCuSO4溶液 | 将称量好的 62.5g CuSO4•5H2O 溶解、冷却、转移、洗涤、定容、摇匀 | 烧杯、玻璃棒、量筒、一定规格的容量瓶、胶头滴管 |
| A. | A | B. | B | C. | C | D. | D |
16.某羧酸酯的分子式为C18H26O5,1mol该酯是由1mol羧酸和2mol乙醇完全反应生成,该羧酸的分子式为( )
| A. | C14H10O5 | B. | C14H16O4 | C. | C14H22O5 | D. | C14H18O5 |
14.无机化合物按照组成和性质可进行如下分类:
(其中②、③、⑥均由Na、K、H、O、S中的3种元素组成)
(1)⑦能使品红溶液褪色且溶于水后形成弱酸,⑦的化学式是SO2,它过量排放到空气中会导致的环境问题是酸雨.
(2)上图“…”可以代表的物质类别是氧化物.
(3)①与③在水溶液中发生反应的离子方程式是H++OH-═H2O.
(4)②与⑥能发生复分解反应,则⑥的化学式是Na2SO3或K2SO3.
(5)酸、碱、盐在水溶液中发生复分解反应的条件是生成沉淀或气体或水.
  | ||||
| 酸 | 碱 | 盐 | … | |
| 实例 | ①HCl ②H2SO4 | ③NaOH ④Ba(OH)2 | ⑤Na2CO3 ⑥Na2SO3或K2SO3 | ⑦SO2 |
(1)⑦能使品红溶液褪色且溶于水后形成弱酸,⑦的化学式是SO2,它过量排放到空气中会导致的环境问题是酸雨.
(2)上图“…”可以代表的物质类别是氧化物.
(3)①与③在水溶液中发生反应的离子方程式是H++OH-═H2O.
(4)②与⑥能发生复分解反应,则⑥的化学式是Na2SO3或K2SO3.
(5)酸、碱、盐在水溶液中发生复分解反应的条件是生成沉淀或气体或水.
 气态烃A燃烧的温度特别高,可用来焊接金属和切割金属且A中碳、氢元素的质量比为12:1.已知B不与Na发生反应,D和E都含有羧基,请回答:
气态烃A燃烧的温度特别高,可用来焊接金属和切割金属且A中碳、氢元素的质量比为12:1.已知B不与Na发生反应,D和E都含有羧基,请回答: .
.