题目内容
14.下列有关试剂存放或实验操作正确的是( )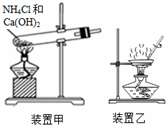
| A. | 液溴应盛放在用水密封且用玻璃塞塞紧的棕色试剂瓶中 | |
| B. | 用湿润的红色石蕊试纸检验酸性气体 | |
| C. | 用装置甲制备氨气 | |
| D. | 用装置乙加热分解Al(OH)3固体 |
分析 A.液溴易挥发;
B.湿润的红色石蕊试纸可检验碱性气体;
C.制备氨气为固体加热装置,试管口应向下倾斜;
D.加热分解Al(OH)3固体,可选择试管.
解答 解:A.液溴易挥发,则液溴应盛放在用水密封且用玻璃塞塞紧的棕色试剂瓶中,故A正确;
B.湿润的红色石蕊试纸可检验碱性气体,遇碱变蓝,而不能检验酸性气体,故B错误;
C.制备氨气为固体加热装置,试管口应向下倾斜,防止生成的水倒流,故C错误;
D.加热分解Al(OH)3固体,可选择试管,而蒸发皿用于可溶性固体与液体的分离,故D错误;
故选A.
点评 本题考查化学实验方案的评价,为高频考点,把握物质的检验、试剂的保存、气体的制备及混合物分离为解答的关键,侧重分析与实验能力的考查,注意实验装置的作用及实验评价性分析,题目难度不大.

练习册系列答案
相关题目
4.设NA为阿伏伽德罗常数的值,下列有关说法不正确的是( )
| A. | 2.3gNa在足量O2中燃烧,转移的电子数为0.1NA | |
| B. | 标准状况下,5.6 L NH3中含有的氢原子数目为0.75NA | |
| C. | 1L0.1mol/LH3PO4溶液中含有的离子数目为0.4NA | |
| D. | 1个C02分子的质量为$\frac{44}{N_A}g$ |
5.利用下列实验装置不能完成相应实验的是( )
| A. | 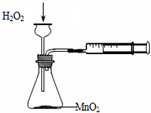 定量测定化学反应速率 | B. | 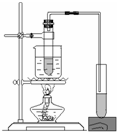 实验室制乙酸丁酯 | ||
| C. | 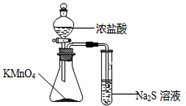 比较KMnO4、Cl2、S的氧化性 | D. | 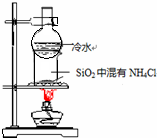 分离SiO2和NH4Cl |
19.下列设计的实验方案能达到实验目的是( )
| A. | 制备Fe(OH)3胶体:在加热时,向0.1 mol•L-1FeCl3溶液中滴加NaOH溶液 | |
| B. | 配制pH=3的CH3COOH溶液:取1 mL 1 mol•L-1CH3COOH溶液加水至100 mL | |
| C. | 提纯含有少量溴的溴苯:向含有少量溴的溴苯中加入过量NaOH溶液充分振荡后,静置、分液,并除去有机相的水 | |
| D. | 比较AgCl、AgI的Ksp:向1 mL浓度均为2 mol•L-1的Cl-、I-的混合溶液中,加入1 mL 2 mol•L-1AgNO3溶液 |
4.25℃时,纯水的电离度为α1,pH=11的氨水中水的电离度为α2;pH=3的盐酸中水的电离度为α3;若将上述氨水与盐酸等体积混合,所得溶液中水的电离度为α4,下列关系正确的( )
| A. | α1<α2<α3<α4 | B. | α3<α2<α1<α4 | C. | α2=α3<α4<α1 | D. | α2=α3<α1<α4 |
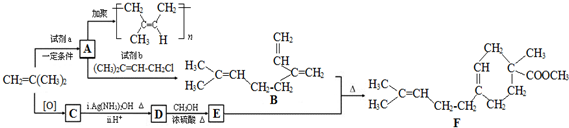
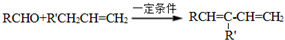
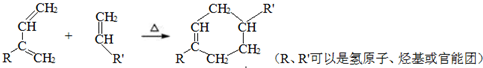
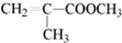 .
.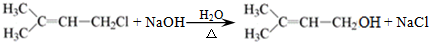 .
.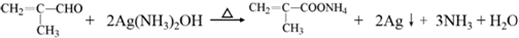 .
.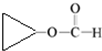 .
.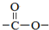 结构.
结构.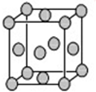 某配位化合物为深蓝色晶体,由原子序数依次增大的A、B、C、D、E五种元素组成,其原子个数比为l4:4:5:1:1. 其中C、D元素同主族且原子序数D为C的二倍,E元素的外围电子排布为(n-l)dn+6ns1,回答下列问题.
某配位化合物为深蓝色晶体,由原子序数依次增大的A、B、C、D、E五种元素组成,其原子个数比为l4:4:5:1:1. 其中C、D元素同主族且原子序数D为C的二倍,E元素的外围电子排布为(n-l)dn+6ns1,回答下列问题. .填出:E原子的核外有29 种不同运动状态的电子,B和C的第一电离能大小关系N>O (用元素符号表示).
.填出:E原子的核外有29 种不同运动状态的电子,B和C的第一电离能大小关系N>O (用元素符号表示).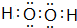 ,两种化合物可任意比互溶,解释其主要原因为H2O与H2O2之间形成氢键.
,两种化合物可任意比互溶,解释其主要原因为H2O与H2O2之间形成氢键.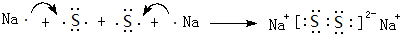 .
.