题目内容
4. 原子序数依次增大的X、Y、Z、W四种元素,X、Z基态原子的2p原子轨道上均有2个未成对电子,W基态原子的除第四层只有1个电子外,其余内层均为全满结构.
原子序数依次增大的X、Y、Z、W四种元素,X、Z基态原子的2p原子轨道上均有2个未成对电子,W基态原子的除第四层只有1个电子外,其余内层均为全满结构.(1)W基态原子的核外电子排布式为1s22s22p63s23p63d104s1.元素X、Y、Z的电负性由大到小的顺序为O>N>C(填元素符号).
(2)与XYZ-互为等电子体的一种分子为CO2(填化学式).
(3)1mol H2XZ3分子中含有σ键的数目为5 mol.
(4)YH3极易溶于水的主要原因是NH3能与水形成氢键.
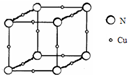
(5)Y与W形成晶体的晶胞如图所示,该晶体的化学式为Cu3N.
分析 原子序数依次增大的X、Y、Z、W四种元素,X、Z基态原子的2p原子轨道上均有2个未成对电子,核外电子排布式分别为1s22s22p2、1s22s22p4,则X为C元素、Z为O元素;Y的原子序数介于碳、氧之间,故Y为N元素;W基态原子的除第四层只有1个电子外,其余内层均为全满结构,原子核外电子数为2+8+18+1=29,故W为Cu.
解答 解:原子序数依次增大的X、Y、Z、W四种元素,X、Z基态原子的2p原子轨道上均有2个未成对电子,核外电子排布式分别为1s22s22p2、1s22s22p4,则X为C元素、Z为O元素;Y的原子序数介于碳、氧之间,故Y为N元素;W基态原子的除第四层只有1个电子外,其余内层均为全满结构,原子核外电子数为2+8+18+1=29,故W为Cu.
(1)W原子核外电子数为29,基态原子的核外电子排布式为1s22s22p63s23p63d104s1,同周期主族元素自左而右电负性增强,故元素X、Y、Z的电负性由大到小的顺序为O>N>C,
故答案为:1s22s22p63s23p63d104s1;O>N>C;
(2)原子总数相等、价电子总数相等的微粒核外等电子体,与CNO-互为等电子体的一种分子为CO2、N2O等,
故答案为:CO2;
(3)H2CO3分子结构式为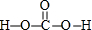 ,1mol H2CO3分子中含有σ键的数目为5mol,
,1mol H2CO3分子中含有σ键的数目为5mol,
故答案为:5 mol;
(4)NH3极易溶于水的主要原因是:NH3能与水形成氢键,
故答案为:NH3能与水形成氢键;
(5)晶胞中Cu原子数目为12×$\frac{1}{4}$=3,N原子数目为8×$\frac{1}{8}$=1,故该晶体的化学式为Cu3N,
故答案为:Cu3N.
点评 本题是对物质结构与性质的考查,涉及核外电子排布、电负性、等电子体、化学键、氢键、晶胞计算等,注意氢键对物质性质的影响,掌握均摊法进行晶胞有关计算.

 口算题卡北京妇女儿童出版社系列答案
口算题卡北京妇女儿童出版社系列答案| A. | 向NaHSO3溶液中通入NH3至中性,溶液中存在:c(NH4+)>c(SO32-) | |
| B. | NH4Cl和NH3•H2O混合液pH=7,一定存在:c(NH4+)>c(Cl-) | |
| C. | NAHCO3溶液中存在HCO3-+H2O═H3O++CO32-,加水稀释后c(H+)减小 | |
| D. | pH相同的氯化铵与硫酸亚铁铵两种溶液中铵根离子浓度前者大 |
| A. | 该反应是氧化还原反应 | B. | 微粒的半径:r(Si)>r(Na) | ||
| C. | 硅酸的酸性强于碳酸 | D. | Na2CO3中含有离子键和共价键 |
| A. | 制备Fe(OH)3胶体:在加热时,向0.1 mol•L-1FeCl3溶液中滴加NaOH溶液 | |
| B. | 配制pH=3的CH3COOH溶液:取1 mL 1 mol•L-1CH3COOH溶液加水至100 mL | |
| C. | 提纯含有少量溴的溴苯:向含有少量溴的溴苯中加入过量NaOH溶液充分振荡后,静置、分液,并除去有机相的水 | |
| D. | 比较AgCl、AgI的Ksp:向1 mL浓度均为2 mol•L-1的Cl-、I-的混合溶液中,加入1 mL 2 mol•L-1AgNO3溶液 |
| A. | 铁在潮湿的空气中易腐蚀 | |
| B. | 棕红色NO2加压后颜色先变深后变浅 | |
| C. | 往往需要在催化剂条件下SO2氧化成SO3 | |
| D. | H2、I2、HI平衡混和气加压后颜色变深 |
| A. | 同系物 | B. | 同分异构体 | C. | 同位素 | D. | 同素异形体 |
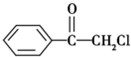 (1)苯氯乙酮是一具有荷花香味且有强催泪作用的化学试剂,它的结构简式如图 所示:则苯氯乙酮不可能具有的化学性质是ABD(填字母序号)
(1)苯氯乙酮是一具有荷花香味且有强催泪作用的化学试剂,它的结构简式如图 所示:则苯氯乙酮不可能具有的化学性质是ABD(填字母序号)
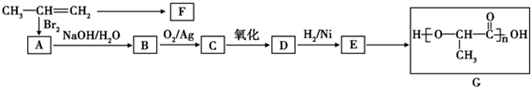
 ;
; ;
; .
.
