题目内容
15.设NA为阿伏加德罗常数的数值.下列说法正确的是( )| A. | 50mL18.4mol/L浓硫酸与足量铜微热反应,生成SO2分子的数目为0.46NA | |
| B. | 某密闭容器盛有0.1mol N2和0.3mol H2,在一定条件下充分反应,转移电子的数目为0 6NA | |
| C. | 若由CO2和O2组成的混合物中共有NA个分子,则其中的氧原子数为2 NA | |
| D. | 常温下,1L 0. 1 mol/L NH4NO3溶液中的氢原子数为0.4 NA |
分析 A、铜只能与浓硫酸反应,和稀硫酸不反应;
B、合成氨的反应为可逆反应;
C、二氧化碳和氧气中均含2个氧原子;
D、NH4NO3溶液中,除了硝酸铵,水也含氢原子.
解答 解:A、铜只能与浓硫酸反应,与稀硫酸不反应,故硫酸不能反应完全,则生成的二氧化硫分子个数小于0.46NA个,故A错误;
B、合成氨的反应为可逆反应,故不能反应完全,则转移的电子数小于0.6NA个,故B错误;
C、由CO2和O2组成的混合物中共有NA个分子,混合气体的物质的量为1mol,其中含有的氧原子的物质的量为2mol,氧原子数为2NA,故C正确;
D、在溶液中还含有大量的水,1L 0. 1 mol/L NH4NO3溶液中的氢原子数大于0.4 NA,故D错误;
故选C.
点评 本题考查了阿伏伽德罗常数的有关计算,熟练掌握公式的使用和物质的结构是解题关键,难度不大.

练习册系列答案
 期末冲刺100分创新金卷完全试卷系列答案
期末冲刺100分创新金卷完全试卷系列答案
相关题目
3.现有溶质为Ba(0H)2、AlCl3、NH4HCO3和H2SO4的四瓶无标签溶液,分别取其中三种溶液于三支试管中,再依次向三支试管中滴加少许剩下的另一种溶液,并稍加热,则下列说法中错误的是( )
| A. | 若一支试管中只产生沉淀,一支试管中无明显现象时,则滴加的是AlCl3溶液 | |
| B. | 若一支试管中只产生沉淀,一支试管中无明显现象时,则滴加的是H2SO4 | |
| C. | 若两支试管中都只产生白色沉淀时,则滴加的是Ba(0H)2溶液 | |
| D. | 若两支试管中既产生沉淀又出现气体时,则滴加的是NH4HCO3溶液 |
10.某混合物含有氯化钠、氯化钾和碳酸钠.经分析知其中氯的质量分数为35.5%,则该混合物中碳酸钠的质量分数可能为( )
| A. | 20% | B. | 30% | C. | 45% | D. | 55% |
20.下列物质不是黄色或淡黄色的是( )
| A. | 单质硫 | B. | 过氧化钠 | C. | 氢氧化铁胶体 | D. | 三氯化铁稀溶液 |
7. 亚硝酸钠是一种工业盐,外观与食盐非常相似,毒性较强.某化学兴趣小组对食盐与亚硝酸钠进行多角度探究:
亚硝酸钠是一种工业盐,外观与食盐非常相似,毒性较强.某化学兴趣小组对食盐与亚硝酸钠进行多角度探究:
(一)鉴别NaCl和NaNO2
甲同学用沉淀分析法:
经查:常温下Ksp(AgNO2)=2×10-8,Ksp(AgCl)=1.8×10-10.分别向盛有5mL 0.0001mol/L两种盐溶液的试合中同时逐滴滴加0.0001mol/L硝酸银溶液,先生成沉淀的是装有NaCl溶液的试管.
乙同学侧定溶液pH:
用pH试纸分别测定0.1mol/L两种盐溶液的pH,测得NaNO2溶液呈碱性.该溶液呈碱性的原因是NO2-+H2O?HNO2+OH-(用离子方程式解释).
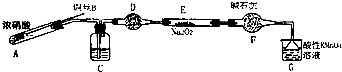
(二)该小组用如图装置(略去夹持仪器)制备亚硝酸钠
已知:①2NO+Na2O2=2NaNO2;
②酸性条件下,NO和NO2都能与MnO4一反应生成NO3一和Mn2+•
(1)使用铜丝的优点是可以控制反应的发生与停止.
(2)装置A中反应方程式为Cu+4HNO3(浓)=Cu(NO3)2+2NO2↑+2H2O.
装置C 中盛放的药品是C;(填字母代号)
A.浓硫酸 B.NaOH 溶液 C.水 D.四氯化碳
仪器F的作用防止水蒸气进入.
(3)该小组称取5.000g制取的样品溶于水配成250.0mL溶液,取25.00mL溶液于锥形瓶中,用0.1000mol/L酸性KMnO4溶液进行滴定,实验所得数据如表所示:
①第一次实验数据出现异常,造成这种异常的原因可能是bc(填字母代号).
a.锥形瓶洗净后未干燥
b.酸式滴定管用蒸馏水洗净后未用标准液润洗
c.滴定终点时仰视读数
②酸性KMnO4溶液滴定亚硝酸钠溶液的离子方程式为2MnO4-+5NO2-+6H+=2Mn2++5NO3-+3H2O.
③该样品中亚硝酸钠的质量分数为69.0%.
 亚硝酸钠是一种工业盐,外观与食盐非常相似,毒性较强.某化学兴趣小组对食盐与亚硝酸钠进行多角度探究:
亚硝酸钠是一种工业盐,外观与食盐非常相似,毒性较强.某化学兴趣小组对食盐与亚硝酸钠进行多角度探究:(一)鉴别NaCl和NaNO2
甲同学用沉淀分析法:
经查:常温下Ksp(AgNO2)=2×10-8,Ksp(AgCl)=1.8×10-10.分别向盛有5mL 0.0001mol/L两种盐溶液的试合中同时逐滴滴加0.0001mol/L硝酸银溶液,先生成沉淀的是装有NaCl溶液的试管.
乙同学侧定溶液pH:
用pH试纸分别测定0.1mol/L两种盐溶液的pH,测得NaNO2溶液呈碱性.该溶液呈碱性的原因是NO2-+H2O?HNO2+OH-(用离子方程式解释).
(二)该小组用如图装置(略去夹持仪器)制备亚硝酸钠
已知:①2NO+Na2O2=2NaNO2;
②酸性条件下,NO和NO2都能与MnO4一反应生成NO3一和Mn2+•
(1)使用铜丝的优点是可以控制反应的发生与停止.
(2)装置A中反应方程式为Cu+4HNO3(浓)=Cu(NO3)2+2NO2↑+2H2O.
装置C 中盛放的药品是C;(填字母代号)
A.浓硫酸 B.NaOH 溶液 C.水 D.四氯化碳
仪器F的作用防止水蒸气进入.
(3)该小组称取5.000g制取的样品溶于水配成250.0mL溶液,取25.00mL溶液于锥形瓶中,用0.1000mol/L酸性KMnO4溶液进行滴定,实验所得数据如表所示:
| 滴定次数 | 1 | 2 | 3 | 4 |
| 消耗KMnO4溶液体积/mL | 20.70 | 20.12 | 20.00 | 19.88 |
a.锥形瓶洗净后未干燥
b.酸式滴定管用蒸馏水洗净后未用标准液润洗
c.滴定终点时仰视读数
②酸性KMnO4溶液滴定亚硝酸钠溶液的离子方程式为2MnO4-+5NO2-+6H+=2Mn2++5NO3-+3H2O.
③该样品中亚硝酸钠的质量分数为69.0%.
4.氯化亚铁具有独有的脱色能力,适用于染料、染料中间体、印染、造纸行业的污水处理.某课题小组设计如下方案制备氯化亚铁并探究氯化亚铁(Fe2+)的还原性.
某同学选择下列装置用氯化铁制备少量氯化亚铁(装置不可以重复使用).查阅资料知,氯化铁遇水剧烈水解,在加热条件下氢气还原氯化铁生成FeCl2和HCl.
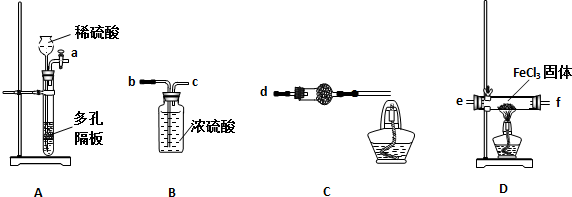
(1)实验开始前应先检查装置的气密性,请叙述装置A气密性检验的方法:关闭活塞,向长颈漏斗内注水至形成一段水柱且液面高度不变,说明装置气密性良好
(2)气流从左至右,装置接口连接顺序是ab c e f d
(3)装置C中干燥管中所盛试剂的名称是:碱石灰或生石灰,作用是:除去HCl、并防止空气中水的进入
(4)装置C中酒精灯的作用是:燃烧H2,防止污染空气
(5)为了测定氯化亚铁的质量分数,某同学进行了如下实验:
称取实验制备的氯化亚铁样品5.435g,配成溶液,用1.00mol•L-1酸性KMnO4标准溶液滴定至终点.(已知还原性Fe2+>Cl-)滴定结果如表所示:
①写出滴定过程中所发生的2个离子方程式:MnO4-+5Fe2++8H+═Mn2++5Fe3++4H2O,2MnO4-+16H++10Cl-=2Mn2++5Cl2↑+8H2O
②样品中氯化亚铁的质量分数为70.1%.
某同学选择下列装置用氯化铁制备少量氯化亚铁(装置不可以重复使用).查阅资料知,氯化铁遇水剧烈水解,在加热条件下氢气还原氯化铁生成FeCl2和HCl.

(1)实验开始前应先检查装置的气密性,请叙述装置A气密性检验的方法:关闭活塞,向长颈漏斗内注水至形成一段水柱且液面高度不变,说明装置气密性良好
(2)气流从左至右,装置接口连接顺序是ab c e f d
(3)装置C中干燥管中所盛试剂的名称是:碱石灰或生石灰,作用是:除去HCl、并防止空气中水的进入
(4)装置C中酒精灯的作用是:燃烧H2,防止污染空气
(5)为了测定氯化亚铁的质量分数,某同学进行了如下实验:
称取实验制备的氯化亚铁样品5.435g,配成溶液,用1.00mol•L-1酸性KMnO4标准溶液滴定至终点.(已知还原性Fe2+>Cl-)滴定结果如表所示:
| 滴定次数 | 标准溶液的体积 | |
| 滴定前刻度/mL | 滴定后刻度/mL | |
| 1 | 1.04 | 25.03 |
| 2 | 1.98 | 25.99 |
| 3 | 3.20 | 25.24 |
②样品中氯化亚铁的质量分数为70.1%.
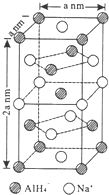 氢化铝钠(NaAlH4)是一种新型轻质储氢材料,掺入少量Ti的NaAlH4在150℃时释氢,在170℃、15.2MPa条件下又重复吸氢.NaAlH4可由AlCl3和NaH在适当条件下合成.NaAlH4的晶胞结构如图所示.
氢化铝钠(NaAlH4)是一种新型轻质储氢材料,掺入少量Ti的NaAlH4在150℃时释氢,在170℃、15.2MPa条件下又重复吸氢.NaAlH4可由AlCl3和NaH在适当条件下合成.NaAlH4的晶胞结构如图所示.  .
.  .
.  (标明配位键).
(标明配位键).