题目内容
5.钨是熔点最高的金属,是重要的战略物资.自然界中钨主要存在于黑钨矿中,其主要成分是铁和锰的钨酸盐(FeWO4、MnWO4),还含少量Si、P、As的化合物.由黑钨矿冶炼钨的工艺流程如图2: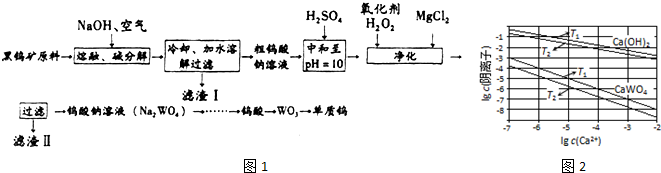
已知:①滤渣I的主要成份是Fe2O3、MnO2.
②上述流程中,只有最后一步钨的化合价改变.
③常温下钨酸难溶于水.
回答下列问题:
(1)钨酸盐(FeWO4、MnWO4)中钨元素的化合价为+6,请写出MnWO4在熔融条件下发生碱分解反应的化学方程式2MnWO4+O2+4NaOH$\frac{\underline{\;高温\;}}{\;}$2MnO2+2Na2WO4+2H2O.
(2)上述流程中向粗钨酸钠溶液中加硫酸调pH=10后,溶液中的杂质阴离子含有SiO32-、HAsO32-、HAsO42-、HPO42-等,则“净化”过程中,加入H2O2时发生反应的离子方程式为H2O2+HAsO32-═HAsO42-+H2O,滤渣II的主要成分是MgSiO3、MgHAsO4、MgHPO4
(3)已知氢氧化钙和钨酸钙(CaWO4)都是微溶电解质,两者的溶解度均随温度升高而减小.图2为不同温度下Ca(OH)2、CaWO4的沉淀溶解平衡曲线,则:
①T1<T2(填“>”或“<”);
②T1时Ksp(CaWO4)=1×10-10mol•L-1.将钨酸钠溶液加入石灰乳得到大量钨酸钙,发生反应的离子方程式为WO42-+Ca(OH)2=CaWO4+2OH-,T2时该反应的平衡常数为1×103mol•L-1.
分析 由流程可知,钨酸亚铁和氢氧化钠、氧气反应生成氧化铁和钨酸钠,钨酸锰和氢氧化钠反应生成钨酸钠和氢氧化锰,水浸时,氧化铁和氢氧化锰不溶于水,钨酸钠溶于水,故过滤后得到的滤液含钨酸钠,滤渣I的主要成份是Fe2O3、MnO2,钨酸钠和浓硫酸反应生成钨酸和硫酸钠;加入过氧化氢,氧化+5价的钨为+6价,加入氯化镁,生成难溶于水的MgSiO3、MgHAsO4、MgHPO4,过滤,滤液为钨酸钠,酸化,加热分解产生三氧化钨和水,用还原剂还原三氧化钨生成钨.
(1)根据在化合物中正负化合价代数和为零,确定钨酸盐(FeWO4、MnWO4)中钨元素的化合价;根据流程图的提示锰的钨酸盐和氢氧化钠和氧气反应生成MnO2等物质;
(2)根据以上分析,加入H2O2的目的是将HAsO32-氧化成HAsO42-,据此书写离子反应方程式;
(3)①根据两者的溶解度均随温度升高而减小分析;
②T1时KSP(CaWO4)=c(Ca2+)•c(WO42-),根据表中该温度下离子的浓度代入计算即可;将钨酸钠溶液加入石灰乳得到钨酸钙沉淀和氢氧根离子,据此书写离子反应式,反应平衡常数K等于生成物平衡浓度系数次方之积和反应物平衡浓度系数次方之积,据此计算T2时该反应的平衡常数.
解答 解:(1)钨酸盐FeWO4为钨酸亚铁,钨酸盐(FeWO4、MnWO4)中铁、锰的化合价都为+2价,设钨酸盐(FeWO4、MnWO4)中钨元素的化合价为+x,因化合物中正负化合价代数和为零,则+2+x+(-2)×4=0,解得x=+6,黑钨矿的主要成分是铁和锰的钨酸盐,根据流程图的提示知,黑钨矿在空气中熔融生成WO42-、MnO2,、Fe2O3等,其中转化中生成MnO2的化学反应方程式为2MnWO4+O2+4NaOH$\frac{\underline{\;高温\;}}{\;}$2MnO2+2Na2WO4+2H2O,
故答案为:+6;2MnWO4+O2+4NaOH$\frac{\underline{\;高温\;}}{\;}$2MnO2+2Na2WO4+2H2O;
(2)根据以上分析,加入H2O2的目的是将HAsO32-氧化成HAsO42-,离子方程式为H2O2+HAsO32-═HAsO42-+H2O,滤液I中存在SiO32-、HAsO32-、HAsO42-、HPO42-等离子,经过调解pH值后,加入氯化镁,Mg2+沉淀SiO32-、HAsO32-、HAsO42-、HPO42-等离子,滤渣Ⅱ的主要成分是MgSiO3、MgHAsO4、MgHPO4,
故答案为:H2O2+HAsO32-═HAsO42-+H2O;MgSiO3、MgHAsO4、MgHPO4;
(3)①根据图象可知,氢氧化钙和钨酸钙(CaWO4)在钙离子浓度相同时,T1温度下阴离子浓度大于T2,说明T1时的溶度积大于T2,溶度积越大,则溶解度越大,所以T1时溶解度较大,由于“已知氢氧化钙和钨酸钙(CaWO4)都是微溶电解质,两者的溶解度均随温度升高而减小”,则T1<T2,
故答案为:<;
②T1时KSP(CaWO4)=c(Ca2+)•c(WO42-)=1×10-5×1×10-5=1×10-10,将钨酸钠溶液加入石灰乳,发生复分解反应,氢氧化钙和钨酸根离子反应生成钨酸钙沉淀,反应的离子方程式为:WO42-+Ca(OH)2=CaWO4+2OH-,T2温度下c(Ca2+)=10-4mol/L时,根据图象可知c(OH-)=10-2mol/L、c(WO42-)=10-7mol/L,平衡常数K等于生成物平衡浓度系数次方之积和反应物平衡浓度系数次方之积,即K=$\frac{{c}^{2}(O{H}^{-})}{c(W{{O}_{4}}^{2-})}$=$\frac{({1{0}^{-2})}^{2}}{1{0}^{-7}}$=1×103,
故答案为:1×10-10;WO42-+Ca(OH)2=CaWO4+2OH-;1×103.
点评 本题以钨矿原料制备W的工艺流程为载体,考查了制备方案的设计,题目难度中等,涉及氧化还原反应原理、对工艺流程的理解、常用化学用语等知识,理解工艺流程是解题的关键,需要学生具有扎实的基础与综合运用知识分析、解决问题的能力.

| A. | 50mL18.4mol/L浓硫酸与足量铜微热反应,生成SO2分子的数目为0.46NA | |
| B. | 某密闭容器盛有0.1mol N2和0.3mol H2,在一定条件下充分反应,转移电子的数目为0 6NA | |
| C. | 若由CO2和O2组成的混合物中共有NA个分子,则其中的氧原子数为2 NA | |
| D. | 常温下,1L 0. 1 mol/L NH4NO3溶液中的氢原子数为0.4 NA |
| A. | 有气泡产生,该气体能使带火星的火柴梗复燃 | |
| B. | 反应后溶液中有晶体析出 | |
| C. | 反应前后溶液中钠离子的浓度不变 | |
| D. | 反应前后溶液中钠离子的质量不变 |
①淀粉、油脂、蛋白质在一定条件下都能发生水解反应
②“乙醇汽油”是在汽油中加入适量乙醇的一种燃料,它是一种新型化合物
③为除去乙酸乙酯中残留的乙酸,可加过量饱和碳酸钠溶液振荡后,静置分液
④石油的分馏和煤的气化都是发生了化学变化
⑤淀粉遇碘酒变蓝色,在加热条件下葡萄糖能与新制Cu(OH)2悬浊液发生反应.
| A. | ①②③ | B. | ①③④ | C. | ③④⑤ | D. | ①③⑤ |
| A. | Cu2+、SO42-、OH-、K+ | B. | Fe3+、SCN-、Cl-、H+ | ||
| C. | K+、CO32-、Cl-、H+ | D. | H+、Na+、Cl-、SO42- |
| X | Y | Z | |
| R | W | ||
| T |
| A. | X有多种同素异形体,而Z不存在同素异形体 | |
| B. | RCl3溶液与Na2W溶液可反应生成一种白色沉淀 | |
| C. | T是一种非金属元素 | |
| D. | 简单离子半径大小关系为W>R>Z>Y |
 下列所列各组物质中,物质之间通过一步反应就能实现如图所示转化的是( )
下列所列各组物质中,物质之间通过一步反应就能实现如图所示转化的是( )| 物质 选项 | a | b | c |
| A | Al | AlCl3 | Al(OH)3 |
| B | HNO3 | NO | NO2 |
| C | Si | SiO2 | H2SiO3 |
| D | H2SO4 | SO2 | SO3 |
| A. | A | B. | B | C. | C | D. | D |