题目内容
10.某混合物含有氯化钠、氯化钾和碳酸钠.经分析知其中氯的质量分数为35.5%,则该混合物中碳酸钠的质量分数可能为( )| A. | 20% | B. | 30% | C. | 45% | D. | 55% |
分析 假设混合物质量为100g,根据氯的质量分数可求出混合物中含Cl-为1mol,则NaCl和KCl的总物质的量为1mol,可得NaCl和KCl的总质量在58.5g到74.5g之间,解得二者质量分数之和范围,进而计算Na2CO3的质量分数范围.
解答 解:假设混合物质量为100g,则混合物中含Cl-为$\frac{100g×35.5%}{35.5g/mol}$=mol,则NaCl和KCl的总物质的量为1mol,NaCl和KCl的总质量在58.5g到74.5g之间,即其质量分数之和在58.5%到74.5%之间,则Na2CO3的质量分数应在25.5%到41.5%之间,
故选:B.
点评 本题考查溶液质量分数计算,注意利用特殊值法简化计算,关键是确定氯化钠与氯化钾的质量分数范围.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
18.合成高分子材料PC的反应如图所示,下列说法不正确的是( )
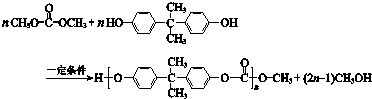

| A. | PC含有酯基 | |
| B. | 合成PC的反应为缩聚反应 | |
| C. | 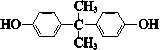 与 与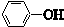 互为同系物 互为同系物 | |
| D. | 1 mol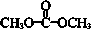 最多能与2 mol NaOH完全反应 最多能与2 mol NaOH完全反应 |
1.近年来我国汽车拥有量呈较快增墙长趋势,NOx、CO是汽车尾气中的主要污染物,
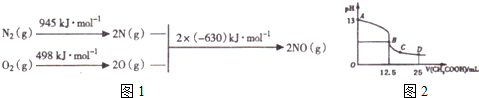
(1)汽车发动机工作时会引发N2和O2反应,其能量变化示意图如图1如下:
写出该反应的热化学方程式N2(g)+O2(g)=2NO(g)△H=+183KJ/mol
(2)在汽车上安装三效催化转化器,可使汽车尾气中的主要污染物(CO、NOx.碳氢化合 物)进行相互反应,生成无毒物质,在某温度时,探究某种催化剂作用下反应 2NO+2CO?N2+2CO2△H<0的反应速率.用气体传感器测得不同时间的 NO和C0浓度如下表:
请回答下列问题:
①计算以v(CO)表示0-3s内的反应速率2.83×10-4mol•L-1•s-1在该温度下反应的平衡常数K=11250L•mol-1
②对于该可逆反应,通过综合分析以上信息,至少可以说明BC(填宇母)
A.该反应使用催化意义不大
B.该反应一旦发生将在很短的时间内完成
C.该反应体系达到平时至少有一种反应物的百分含量减小
(3)C0分析仪的传感器可测定汽车尾气是否符合排放标准.该分析仪的工作原理类似于燃料电池,其中电解质是氧化钇(Y2A3)和氧化锆(ZrO2)晶体.能传导02-则负极的电极反应式为CO+O2--2e-═CO2,以该电池为电源.以石墨为电极,电解2LO.1mol•L-1KCl溶液,写出电解反应的离子方程式2Cl-+2H2O$\frac{\underline{\;通电\;}}{\;}$2OH-+H2↑+Cl2↑,电解一段时间后.取25mL上述电解后的溶液.滴加0.21mol•L-1醋酸得到如图2曲线 (不考虑能量损失和气体溶于水,溶液体积变化忽略不计).根据图计算,上述电解过程中消耗一氧化碳的质量为2.8g.

(1)汽车发动机工作时会引发N2和O2反应,其能量变化示意图如图1如下:
写出该反应的热化学方程式N2(g)+O2(g)=2NO(g)△H=+183KJ/mol
(2)在汽车上安装三效催化转化器,可使汽车尾气中的主要污染物(CO、NOx.碳氢化合 物)进行相互反应,生成无毒物质,在某温度时,探究某种催化剂作用下反应 2NO+2CO?N2+2CO2△H<0的反应速率.用气体传感器测得不同时间的 NO和C0浓度如下表:
| 时间(s) | 0 | 1 | 2 | 3 | 4 | 5 |
| c(NO) (×lO-4mol•L-1) | 10.0 | 4.50 | 2.50 | 1.50 | 1.00 | 1.00 |
| c(CO) (×lO-3mol•L-1) | 2.70 | 2.15 | 1.95 | 1.85 | 1.80 | 1.80 |
①计算以v(CO)表示0-3s内的反应速率2.83×10-4mol•L-1•s-1在该温度下反应的平衡常数K=11250L•mol-1
②对于该可逆反应,通过综合分析以上信息,至少可以说明BC(填宇母)
A.该反应使用催化意义不大
B.该反应一旦发生将在很短的时间内完成
C.该反应体系达到平时至少有一种反应物的百分含量减小
(3)C0分析仪的传感器可测定汽车尾气是否符合排放标准.该分析仪的工作原理类似于燃料电池,其中电解质是氧化钇(Y2A3)和氧化锆(ZrO2)晶体.能传导02-则负极的电极反应式为CO+O2--2e-═CO2,以该电池为电源.以石墨为电极,电解2LO.1mol•L-1KCl溶液,写出电解反应的离子方程式2Cl-+2H2O$\frac{\underline{\;通电\;}}{\;}$2OH-+H2↑+Cl2↑,电解一段时间后.取25mL上述电解后的溶液.滴加0.21mol•L-1醋酸得到如图2曲线 (不考虑能量损失和气体溶于水,溶液体积变化忽略不计).根据图计算,上述电解过程中消耗一氧化碳的质量为2.8g.
18.弱电解质在水中的电离达到平衡状态时,己电离的溶质的分子数占原有溶质分子总数(包括已电离的和未电离的)的百分率,称为电离度.某温度下,0.lmol•L-1的某一元弱酸溶液电离度为a%,则该溶液的pH为( )
| A. | 1 | B. | l-a | C. | 2-lga | D. | 3-lga |
5.下列说法不正确的是( )
| A. | 分子式为C5H12的化合物,其一氯代物种类(不考虑立体异构)不可能是2种 | |
| B. | 棉花、羊毛、蚕丝均属于天然纤维 | |
| C. | 乙二酸二乙酯、乙二酸乙二酯、二乙酸乙二酯它们互为同分异构体 | |
| D. | 石油裂化、油脂皂化和煤的干馏都是化学变化,而石油的分馏和蛋白质的盐析都是物理变化 |
15.设NA为阿伏加德罗常数的数值.下列说法正确的是( )
| A. | 50mL18.4mol/L浓硫酸与足量铜微热反应,生成SO2分子的数目为0.46NA | |
| B. | 某密闭容器盛有0.1mol N2和0.3mol H2,在一定条件下充分反应,转移电子的数目为0 6NA | |
| C. | 若由CO2和O2组成的混合物中共有NA个分子,则其中的氧原子数为2 NA | |
| D. | 常温下,1L 0. 1 mol/L NH4NO3溶液中的氢原子数为0.4 NA |
2.下列物质的颜色不是黑色的是( )
| A. | 还原Fe粉 | B. | FeO | C. | Fe3O4 | D. | Fe2O3 |
19.CH3CH2Br与NH3反应生成(CH3CH2)2NH和HBr,下列说法错误的是( )
| A. | CH3CH2Br难溶于水 | |
| B. | 该反应属于取代反应 | |
| C. | CH3CH2Br与HBr均属于电解质 | |
| D. | 若原料完全反应生成上述产物,CH3CH2Br与NH3的物质的量之比为2:1 |
20.能在溶液中大量共存的一组离子是( )
| A. | Cu2+、SO42-、OH-、K+ | B. | Fe3+、SCN-、Cl-、H+ | ||
| C. | K+、CO32-、Cl-、H+ | D. | H+、Na+、Cl-、SO42- |