题目内容
8.化学与生产、生活密切相关.下列叙述正确的是( )| A. | 煤的干馏和煤的液化均是物理变化 | |
| B. | 用活性炭为糖浆脱色和用次氯酸盐漂白纸浆的原理相同 | |
| C. | 天然纤维和合成纤维的主要成分都是纤维素 | |
| D. | 海水淡化的方法有蒸馏法、电渗析法等 |
分析 A.煤的干馏和煤的液化都是化学变化;
B.活性炭脱色是利用其吸附性;
C.蚕丝是天然纤维;
D.海水淡化是指除去海水中的盐分以获得淡水的工艺过程(又称海水脱盐),其方法较多.
解答 解:A.煤的干馏是指将煤隔绝空气加强热使之分解的过程,煤液化生成甲醇,属于化学变化,故A错误;
B.活性炭脱色是利用其吸附性,次氯酸盐漂白是利用次氯酸的强氧化性,故B错误;
C.蚕丝是天然纤维,成分为蛋白质,合成纤维的成分是化学纤维,如聚乙烯,故C错误;
D.海水淡化是指除去海水中的盐分以获得淡水的工艺过程(又称海水脱盐),蒸馏是分离和提纯液态混合物常用的方法之一蒸馏法是人类最早使用的淡化海水的方法,技术和工艺比较完备;离子交换法是用阳离子交换树脂(HR)和水中的金属离子Mn+进行交换的一种方法,通常通过阳离子交换树脂可以除去钙离子和镁离子得到软水,不是历史最久、技术和工艺较完善的主要方法;电渗析法是一种利用离子交换膜进行离子交换的方法,是近年发展起来的一种较好的海水淡化技术,原理为通电后,阴离子移向阳极,阳离子移向阴极,分离盐和水,故D正确.
故选D.
点评 本题考查化学与生活、环境的关系,为高考常见考题,为理综中化学选择题首先出现的习题,涉及知识面较广,侧重分析与应用、化学与生活、环境等综合知识的考查,题目难度不大.

练习册系列答案
相关题目
18.亚硝酸(HNO2)既可作氧化剂又可作还原剂,当它在反应中作还原剂时,可能生成的产物是( )
| A. | N2 | B. | N2O3 | C. | NH3 | D. | NO2 |
19.欲检验在制得的HCl气体中是否混有少量Cl2的方法是( )
| A. | 用酚酞试纸 | B. | 用湿润的蓝色石蕊试纸 | ||
| C. | 用硝酸银溶液 | D. | 用湿润的淀粉-KI试纸 |
16.常温时将pH=8的NaOH与pH=10的NaOH溶液等体积混合,溶液反应后c(H+)最接近于( )
| A. | (10-8+10-10)mol•L-1 | B. | (10-4+10-6)mol•L-1 | ||
| C. | (10-6+10-10)mol•L-1 | D. | 2×10-10 mol•L-1 |
3.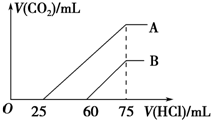 向浓度相等、体积均为50mL的A、B两份NaOH溶液中,分别通入一定量的CO2后,再稀释到100mL.在稀释后的溶液中逐滴加入0.1mol.L-1的盐酸,产生CO2的体积(标准状况)与所加盐酸的体积关系如图所示.下列说法正确的是( )
向浓度相等、体积均为50mL的A、B两份NaOH溶液中,分别通入一定量的CO2后,再稀释到100mL.在稀释后的溶液中逐滴加入0.1mol.L-1的盐酸,产生CO2的体积(标准状况)与所加盐酸的体积关系如图所示.下列说法正确的是( )
 向浓度相等、体积均为50mL的A、B两份NaOH溶液中,分别通入一定量的CO2后,再稀释到100mL.在稀释后的溶液中逐滴加入0.1mol.L-1的盐酸,产生CO2的体积(标准状况)与所加盐酸的体积关系如图所示.下列说法正确的是( )
向浓度相等、体积均为50mL的A、B两份NaOH溶液中,分别通入一定量的CO2后,再稀释到100mL.在稀释后的溶液中逐滴加入0.1mol.L-1的盐酸,产生CO2的体积(标准状况)与所加盐酸的体积关系如图所示.下列说法正确的是( )| A. | 在NaOH溶液中通入一定量的CO2后,溶液中溶质的组成可能是①NaOH、Na2CO3 ②Na2CO3③Na2CO3、NaHCO3 ④NaHCO3 | |
| B. | B曲线说明,原溶液通入CO2后,所得溶质与盐酸反应产生CO2的最大体积是11.2L(标准状况) | |
| C. | 原NaOH溶液的物质的量浓度为0.100mol/L | |
| D. | B曲线表明,原溶液通入CO2后,所得溶液中溶质的化学式为NaOH、Na2CO3 |
20.t℃时,在2L密闭、恒压容器中充入1molA和1molB,发生反应:A(g)+B(g)?C(g). 5min后达到平衡,测得C的物质的量分数为60%,则下列说法正确的是( )
| A. | 5min内平均反应速率vA=0.15mol•L-1•min-1 | |
| B. | 当同时对原平衡体系升高一定温度和增加一定压强时,达平衡后,C的物质的量分数为60%,则该反应的正反应为吸热反应 | |
| C. | 保持其他条件不变,若起始时向容器中加入0.5molA、0.5molB、1.5molC,则反应将向逆反应方向进行 | |
| D. | t℃,向2L密闭、恒容容器中仍充入1molA和1molB,反应达到平衡状态时,C的物质的量分数小于60% |
17. 已知反应:2SO2(g)+O2(g)?2SO3(g)△H<0.一定温度下,在容积为2L的甲、乙、丙三个恒温密闭容器中,充入的SO2(g)和O2(g)的量如图所示:
已知反应:2SO2(g)+O2(g)?2SO3(g)△H<0.一定温度下,在容积为2L的甲、乙、丙三个恒温密闭容器中,充入的SO2(g)和O2(g)的量如图所示:
下列判断正确的是( )
 已知反应:2SO2(g)+O2(g)?2SO3(g)△H<0.一定温度下,在容积为2L的甲、乙、丙三个恒温密闭容器中,充入的SO2(g)和O2(g)的量如图所示:
已知反应:2SO2(g)+O2(g)?2SO3(g)△H<0.一定温度下,在容积为2L的甲、乙、丙三个恒温密闭容器中,充入的SO2(g)和O2(g)的量如图所示:下列判断正确的是( )
| A. | 三个容器中的反应速率相同 | |
| B. | 丙中的平衡常数最大,甲中最小 | |
| C. | 当容器甲中SO2的转化率为80%时,该反应的平衡常数为160 | |
| D. | 达到平衡时,容器丙中的c(SO3)是容器甲中的两倍 |

 将0.1mol的镁、铝混合物溶于100mL 2mol•L-1的H2SO4溶液中,然后再滴加1mol•L-1的NaOH溶液.请回答:
将0.1mol的镁、铝混合物溶于100mL 2mol•L-1的H2SO4溶液中,然后再滴加1mol•L-1的NaOH溶液.请回答: