题目内容
5.莽草酸的结构式如图: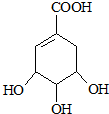
请回答:(1)写出莽草酸分子中官能团名称羟基、碳碳双键、羧基.
(2)该有机物分子1moL最多能和1moL NaOH发生反应.以下是以莽草酸A为原料的有机合成路线:
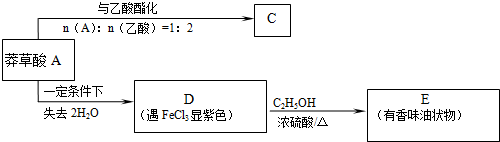
已知D的碳环上一氯代物只有两种.请继续回答下列问题:
(3)C有三种同分异构体,写出其中的一种结构简式
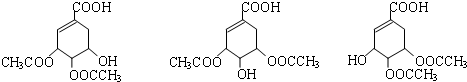 .
.(4)莽草酸A→D的反应类型是:消去反应.
(5)写出下列反应的化学方程式:①D→E
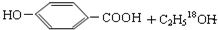 $→_{△}^{浓硫酸}$
$→_{△}^{浓硫酸}$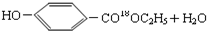 ②E与足量的NaOH溶液反应
②E与足量的NaOH溶液反应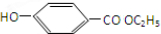 +2NaOH→
+2NaOH→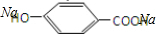 +H2O.
+H2O.
分析 (1)草莽酸含有羟基、碳碳双键、羧基等官能团;
(2)能与氢氧化钠反应的官能团为羧基;
(3)草莽酸含有羟基,可与乙酸发生酯化反应,如与乙酸铵1:2发生酯化反应,可生成三种有机物,C可能为 ,D遇氯化铁变紫色,说明D中含有酚羟基,D的碳环上一氯代物只有两种,应为对称结构,则D可能为
,D遇氯化铁变紫色,说明D中含有酚羟基,D的碳环上一氯代物只有两种,应为对称结构,则D可能为 ,E为
,E为 ,以此解答(3)、(4)(5).
,以此解答(3)、(4)(5).
解答 解:(1)由结构简式可知草莽酸含有羟基、碳碳双键、羧基等官能团,故答案为:羟基、碳碳双键、羧基;
(2)能与氢氧化钠反应的官能团为羧基,分子中含有1个羧基,则可与1mol氢氧化钠反应,故答案为:1;
(3)草莽酸含有羟基,可与乙酸发生酯化反应,如与乙酸铵1:2发生酯化反应,可生成三种有机物,C可能为 ,D遇氯化铁变紫色,说明D中含有酚羟基,D的碳环上一氯代物只有两种,应为对称结构,则D可能为
,D遇氯化铁变紫色,说明D中含有酚羟基,D的碳环上一氯代物只有两种,应为对称结构,则D可能为 ,E为
,E为 ,由以上分析可知C可能为
,由以上分析可知C可能为 ,
,
故答案为: ;
;
(4)根据题干推断可知A 到D
到D 的反应为消去反应,故答案为:消去反应;
的反应为消去反应,故答案为:消去反应;
(5)①D→E的反应为酯化反应,反应的方程式为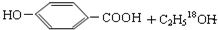 $→_{△}^{浓硫酸}$
$→_{△}^{浓硫酸}$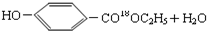 ,
,
故答案为: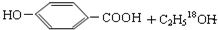 $→_{△}^{浓硫酸}$
$→_{△}^{浓硫酸}$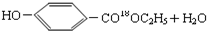 ;
;
②E为 ,与氢氧化钠反应的方程式为
,与氢氧化钠反应的方程式为  +2NaOH→
+2NaOH→ +H2O,
+H2O,
故答案为: +2NaOH→
+2NaOH→ +H2O.
+H2O.
点评 本题考查有机物的合成与推断,侧重于学生的分析能力的考查,为高频考点,注意把握有机物的结构和官能团的性质,为解答该题的关键,难度不大.

练习册系列答案
 暑假衔接培优教材浙江工商大学出版社系列答案
暑假衔接培优教材浙江工商大学出版社系列答案 欣语文化快乐暑假沈阳出版社系列答案
欣语文化快乐暑假沈阳出版社系列答案
相关题目
4.下列有关物质与其用途不相对应的是( )
| A. | 氮化硅陶瓷--导热剂 | B. | Si和Ge--半导体材料 | ||
| C. | 钢化玻璃--汽车窗玻璃 | D. | SiO2--制光纤 |
16.下列反应属于放热反应的是( )
| A. | 氯化铵与八水合氢氧化钡反应 | |
| B. | 碳与水蒸气高温制取水煤气 | |
| C. | 氢氧化钾和硫酸中和 | |
| D. | 碳酸钙高温分解成氧化钙和二氧化碳 |
20.下列物质直接排放不会引起环境污染的是( )
| A. | 甲醛 | B. | 苯酚 | C. | 氮气 | D. | 二氧化硫 |
10.下列离子方程式书写正确的是( )
| A. | 氯气溶于水:H2O+Cl2═2H++ClOˉ+Clˉ | |
| B. | 锌片插入稀H2SO4溶液中:Zn+2H+═Zn2++H2↑ | |
| C. | 氢氧化钡溶液与稀硫酸反应:H++SO42-+OH-+Ba2+═H2O+BaSO4↓ | |
| D. | 碳酸钙溶于稀盐酸:CO32-+2H+═H2O+CO2↑ |
17.过氧化钙(CaO2)难溶于水,广泛应用于渔业、农业、环保等许多方面.
I.CaO2的制备:
(1)①在低温下,往过氧化氢浓溶液中投入无水氯化钙发生复分解反应,写出该可逆反应的化学方程式H2O2+CaCl2 CaO2+2HCl.
CaO2+2HCl.
②为控制低温的方式,最好将反应器放置在冰水浴中.
③测得不同温度下,过氧化钙的平均生成速率如下表所示:
请解释速率随温度如此变化的原因40℃之前,温度升高,速率加快;40℃之后,温度继续升高,双氧水分解,浓度下降,反应速率减慢.
(2)一段时间后,再加入氨水,当调节溶液pH至9~11,才出现大量沉淀.用简要的文字解释需用氨水调节pH至9~11的原因NH3•H2O结合HCl,使反应H2O2+CaCl2 CaO2+2HCl平衡向正方向移动,提高过氧化钙的产量.
CaO2+2HCl平衡向正方向移动,提高过氧化钙的产量.
II.CaO2的热稳定性:CaO2在一定温度下能发生可逆反应,生成CaO和O2.
(3)标准生成热的定义为:在某温度下,由处于标准状态的各种元素的最稳定的单质生成标准状态下1mol某纯物质的热效应.已知,CaO2和CaO的标准生成热分别为a kJ•mol-1和b kJ•mol-1,请书写CaO2分解生成CaO和O2的热化学方程式2CaO2(s) 2CaO(s)+O2(g)△H=2(b-a)kJ•mol-1.
2CaO(s)+O2(g)△H=2(b-a)kJ•mol-1.
(4)一定温度下,在2L的恒容容器中进行该反应,反应过程中各物质的物质的量如下表所示:
则该温度下,反应的化学平衡常数K=0.25mol/L.
(5)3s时,若对该容器压缩体积,其它条件不变,则当再次达到平衡时,氧气的浓度不变(填“变大”、“变小”、“不变”、“无法确定”),理由是温度不变,该反应的平衡常数K=c(CO2)=0.25mol/L不变.
(6)下列说法不能说明该反应达到平衡的是a(填字母).
a.气体的密度不再改变 b.固体质量不再改变
c.正反应速率不再改变 d.逆反应速率不再改变.
I.CaO2的制备:
(1)①在低温下,往过氧化氢浓溶液中投入无水氯化钙发生复分解反应,写出该可逆反应的化学方程式H2O2+CaCl2
 CaO2+2HCl.
CaO2+2HCl.②为控制低温的方式,最好将反应器放置在冰水浴中.
③测得不同温度下,过氧化钙的平均生成速率如下表所示:
| 温度(℃) | 20 | 30 | 40 | 50 | 60 | 70 | 80 |
| CaO2平均生成速率(×10-3mol.s-1) | 7.5 | 8.2 | 9.4 | 8.0 | 7.1 | 6.7 | 5.5 |
(2)一段时间后,再加入氨水,当调节溶液pH至9~11,才出现大量沉淀.用简要的文字解释需用氨水调节pH至9~11的原因NH3•H2O结合HCl,使反应H2O2+CaCl2
 CaO2+2HCl平衡向正方向移动,提高过氧化钙的产量.
CaO2+2HCl平衡向正方向移动,提高过氧化钙的产量.II.CaO2的热稳定性:CaO2在一定温度下能发生可逆反应,生成CaO和O2.
(3)标准生成热的定义为:在某温度下,由处于标准状态的各种元素的最稳定的单质生成标准状态下1mol某纯物质的热效应.已知,CaO2和CaO的标准生成热分别为a kJ•mol-1和b kJ•mol-1,请书写CaO2分解生成CaO和O2的热化学方程式2CaO2(s)
 2CaO(s)+O2(g)△H=2(b-a)kJ•mol-1.
2CaO(s)+O2(g)△H=2(b-a)kJ•mol-1.(4)一定温度下,在2L的恒容容器中进行该反应,反应过程中各物质的物质的量如下表所示:
| 时间/s | n(CaO2)/mol | n(CaO)/mol | n(O2)/mol |
| 0 | 2 | 0 | 0 |
| 1 | 1.4 | 0.6 | 0.3 |
| 2 | 1 | 1 | 0.5 |
| 3 | 1 | 1 | 0.5 |
(5)3s时,若对该容器压缩体积,其它条件不变,则当再次达到平衡时,氧气的浓度不变(填“变大”、“变小”、“不变”、“无法确定”),理由是温度不变,该反应的平衡常数K=c(CO2)=0.25mol/L不变.
(6)下列说法不能说明该反应达到平衡的是a(填字母).
a.气体的密度不再改变 b.固体质量不再改变
c.正反应速率不再改变 d.逆反应速率不再改变.
14.NA代表阿伏加德罗常数的值,下列叙述正确的是( )
| A. | 室温下向1 L pH=1的醋酸溶液中加水,所得溶液的H+数目大于0.1NA | |
| B. | 60g乙酸与足量乙醇发生酯化反应,充分反应后断裂的C-O键数目为NA | |
| C. | 某无水乙醇与足量金属钠反应生成5.6 L H2,该乙醇分子中共价键总数为4 NA | |
| D. | 已知C2H4(g)+H2(g)═C2H6(g)△H=-137.0 kI/mol,乙烯与H2加成时放出68.5 kJ热量,则反应过程中被破坏的碳原子之间共用电子对数目为NA |
15.生活中常见的物质中属于电解质的是( )
| A. | 蔗糖 | B. | 黄酒 | C. | 白醋 | D. | 食盐 |