题目内容
10.下列离子方程式书写正确的是( )| A. | 氯气溶于水:H2O+Cl2═2H++ClOˉ+Clˉ | |
| B. | 锌片插入稀H2SO4溶液中:Zn+2H+═Zn2++H2↑ | |
| C. | 氢氧化钡溶液与稀硫酸反应:H++SO42-+OH-+Ba2+═H2O+BaSO4↓ | |
| D. | 碳酸钙溶于稀盐酸:CO32-+2H+═H2O+CO2↑ |
分析 A.次氯酸为弱酸应保留化学式;
B.二者反应生成硫酸锌和氢气;
C.离子个数配比不符合物质结构;
D.碳酸钙为沉淀,应保留化学式.
解答 解:A.氯气溶于水,离子方程式:H2O+Cl2═H++HClO+Clˉ,故A错误;
B.锌片插入稀H2SO4溶液中,离子方程式:Zn+2H+═Zn2++H2↑,故B正确;
C.氢氧化钡溶液与稀硫酸反应,离子方程式:2H++SO42-+2OH-+Ba2+═2H2O+BaSO4↓,故C错误;
D.碳酸钙溶于稀盐酸,离子方程式:CaCO3+2H+═H2O+CO2↑+Ca2+,故D错误;
故选:B.
点评 本题考查离子方程式的书写判断,题目浓度中等,明确离子反应发生条件及离子方程式的书写原则为解答关键,注意化学式的拆分.

练习册系列答案
相关题目
9.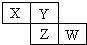 X、Y、Z均为短周期元素,它们在周期表中相对位置如图所示.若Y原子的L层电子是K层电子数的3倍,下列说法不正确的是( )
X、Y、Z均为短周期元素,它们在周期表中相对位置如图所示.若Y原子的L层电子是K层电子数的3倍,下列说法不正确的是( )
 X、Y、Z均为短周期元素,它们在周期表中相对位置如图所示.若Y原子的L层电子是K层电子数的3倍,下列说法不正确的是( )
X、Y、Z均为短周期元素,它们在周期表中相对位置如图所示.若Y原子的L层电子是K层电子数的3倍,下列说法不正确的是( )| A. | Y的气态氢化物比X的稳定 | |
| B. | W的最高价氧化物对应水化物的酸性比Z的强 | |
| C. | Y的非金属性比Z的强 | |
| D. | X与Y形成的化合物都易溶于水 |
1.短周期元素X和元素Y位于不同的周期,元素X原子的最外层电子数为a,次外层电子数为b;元素Y原子的M层电子数为(a-b),L层电子数为(a+b),则关于X、Y两元素形成的化合物的说法正确的是( )
| A. | 属于两性氧化物 | B. | 能与氢氧化钠反应 | ||
| C. | 能与硫酸反应 | D. | 常温下能溶于水 |
18.W、X、Y、Z、M、Q均为除稀有气体外的短周期元素,其原子序数依次增大,X的最外层电子数是W的4倍,Z与M的最低负化合价相同,X、M在周期表中位置如图所示.
(1)Y在周期表中的位置为第二周期第IVA族,Q的元素名称为氯;
(2)X元素的最高价氧化物的电子式为 ;
;
(3)元素的非金属性:M<Q(填“>”、“<”或“=”),写出一个证明此结论的化学方程式H2S+Cl2=2S↓+2HCl;
(4)Z与W形成的4核10个电子离子的电子式为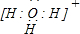 ;
;
(5)X、Y可分别与Z以原子个数比1:1形成化合物丙和丁.在催化剂存在条件下,丙与丁发生反应,生成单质Y2和另一种化合物戊.写出该反应的化学方程式:2CO+2NO$\frac{\underline{\;催化剂\;}}{\;}$N2+2CO2.
| X | ||
| M |
(2)X元素的最高价氧化物的电子式为
 ;
;(3)元素的非金属性:M<Q(填“>”、“<”或“=”),写出一个证明此结论的化学方程式H2S+Cl2=2S↓+2HCl;
(4)Z与W形成的4核10个电子离子的电子式为
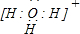 ;
;(5)X、Y可分别与Z以原子个数比1:1形成化合物丙和丁.在催化剂存在条件下,丙与丁发生反应,生成单质Y2和另一种化合物戊.写出该反应的化学方程式:2CO+2NO$\frac{\underline{\;催化剂\;}}{\;}$N2+2CO2.
2.用中和滴定法测定烧碱的纯度(烧碱中的杂质不和酸反应),请根据实验回答:
(1)将称量好的4.3g烧碱样品配制成250mL待测液,配制过程使用的主要仪器除250mL容量瓶、量筒、烧杯、胶头滴管外,还有一种必须使用的仪器是玻璃棒.
(2)用碱式滴定管量取10.00mL待测液于锥形瓶中,滴入几滴酚酞.
(3)用0.20mol•L-1的标准盐酸滴定待测液,判断滴定终点的现象是:滴入最后一滴盐酸时,锥形瓶内溶液恰好由红色变无色,并且半分钟内不变色.
(4)如果实验操作正确,从滴定开始到结束,溶液中的离子浓度关系可以出现的是B、C(填答案字母序号)
A.c(Na+)>c(Cl-)>c(H+)>c(OH-)
B.c(Na+)>c(OH-)>c(Cl-)>c(H+)
C.c(Na+)+c(H+)=c(OH-)+c(Cl-)
D.c(Na+)+c(H+)>c(OH-)+c(Cl-)
(5)根据下列数据计算,c(NaOH)=0.40mol/L,烧碱的纯度为93%(保留整数)
(6)经过分析发现,本次实验的测定结果比烧碱的实际纯度偏高,造成误差的可能原因是C、D(填答案字母序号)
A.滴定前平视,滴定后俯视 B.用标准液润洗滴定管
C.用待测液润洗锥形瓶 D.不小心将标准液滴在锥形瓶外面
E.滴定接近终点时,用少量蒸馏水冲洗锥形瓶内.
(1)将称量好的4.3g烧碱样品配制成250mL待测液,配制过程使用的主要仪器除250mL容量瓶、量筒、烧杯、胶头滴管外,还有一种必须使用的仪器是玻璃棒.
(2)用碱式滴定管量取10.00mL待测液于锥形瓶中,滴入几滴酚酞.
(3)用0.20mol•L-1的标准盐酸滴定待测液,判断滴定终点的现象是:滴入最后一滴盐酸时,锥形瓶内溶液恰好由红色变无色,并且半分钟内不变色.
(4)如果实验操作正确,从滴定开始到结束,溶液中的离子浓度关系可以出现的是B、C(填答案字母序号)
A.c(Na+)>c(Cl-)>c(H+)>c(OH-)
B.c(Na+)>c(OH-)>c(Cl-)>c(H+)
C.c(Na+)+c(H+)=c(OH-)+c(Cl-)
D.c(Na+)+c(H+)>c(OH-)+c(Cl-)
(5)根据下列数据计算,c(NaOH)=0.40mol/L,烧碱的纯度为93%(保留整数)
| 滴定次数 | 待测液体积(mL) | 标准盐酸体积(mL) | |
| 滴定前读数(mL) | 滴定后读数(mL) | ||
| 第一次 | 10.00 | 0.50 | 20.40 |
| 第二次 | 10.00 | 4.00 | 24.10 |
A.滴定前平视,滴定后俯视 B.用标准液润洗滴定管
C.用待测液润洗锥形瓶 D.不小心将标准液滴在锥形瓶外面
E.滴定接近终点时,用少量蒸馏水冲洗锥形瓶内.
19.碳酸锂是重要的锂化合物,是制备其它高纯锂化合物的重要原料.我国锂资源储量非常丰富,其中卤水锂资源约占其中的79%,由盐湖卤水(主要含有:LiCl、MgCl2、Na2B4O7等) 制备碳酸锂,其工艺流程如下:
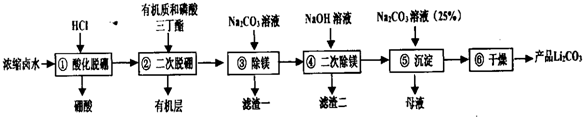
己知:
I、盐卤中的硼元素以Na2B4O7形式存在,硼酸(H3BO3)常温时在水中溶解度不大
Ⅱ、LiOH易溶于水
Ⅲ、
(1)写出①过程的离子方程式B4O72-+2H++5H2O=4H3BO3↓.
(2)②过程中的操作名称是萃取反应,在所得有机层中加入0.25mol/LNaOH溶液可以再生有机质和磷酸三丁酯,但不能加浓NaOH溶液,其原因是避免氢氧化钠溶液浓度过大使磷酸三丁酯水解.
(3)③过程结束后,溶液中C(Li+)=5mol/L,若此过程中不产生Li2CO3沉淀,则此时溶液中镁离子的物质的量浓度不小于0.21mol/L.
(4)滤渣一,滤渣二的主要成分分别是MgCO3、Mg(OH)2.
(5)如何检验第⑤步中Li+是否沉淀完全取少量上层清液于试管中,继续加入碳酸钠溶液若无沉淀出现,则沉淀完全.
(6)髙纯度的碳酸锂可以用于制备锂离子电池的正极材料.如LiCoO2可以采用下面方法制备:将Li2CO3与CoCO3按1:1的比例混合,再在空气中灼烧即可,试写出该反应的化学方程式2Li2CO3+4CoCO3+O2$\frac{\underline{\;\;△\;\;}}{\;}$4LiCoO2+6CO2.
一种钻酸锂电池的工作原理如下:LixC6+Li1-xCoO2=LiCoO2+C6,该电池在充电时负极上发生的电极反应为xLi++xe-+C6=LixC6.

己知:
I、盐卤中的硼元素以Na2B4O7形式存在,硼酸(H3BO3)常温时在水中溶解度不大
Ⅱ、LiOH易溶于水
Ⅲ、
| 物质 | MgCO3 | Li2CO3 | Mg(OH)2 |
| Ksp | 6.82×10-6 | 8.2×10-4 | 5.6×10-12 |
(2)②过程中的操作名称是萃取反应,在所得有机层中加入0.25mol/LNaOH溶液可以再生有机质和磷酸三丁酯,但不能加浓NaOH溶液,其原因是避免氢氧化钠溶液浓度过大使磷酸三丁酯水解.
(3)③过程结束后,溶液中C(Li+)=5mol/L,若此过程中不产生Li2CO3沉淀,则此时溶液中镁离子的物质的量浓度不小于0.21mol/L.
(4)滤渣一,滤渣二的主要成分分别是MgCO3、Mg(OH)2.
(5)如何检验第⑤步中Li+是否沉淀完全取少量上层清液于试管中,继续加入碳酸钠溶液若无沉淀出现,则沉淀完全.
(6)髙纯度的碳酸锂可以用于制备锂离子电池的正极材料.如LiCoO2可以采用下面方法制备:将Li2CO3与CoCO3按1:1的比例混合,再在空气中灼烧即可,试写出该反应的化学方程式2Li2CO3+4CoCO3+O2$\frac{\underline{\;\;△\;\;}}{\;}$4LiCoO2+6CO2.
一种钻酸锂电池的工作原理如下:LixC6+Li1-xCoO2=LiCoO2+C6,该电池在充电时负极上发生的电极反应为xLi++xe-+C6=LixC6.
20.某元素原子的质量数为A,它的阴离子Xn-核外有x个电子,则w克这种元素的原子核内中子的物质的量为( )
| A. | $\frac{A(A-x+n)}{W}mol$ | B. | $\frac{w(A+x-n)}{A}mol$ | C. | $\frac{w(A-x+n)}{A}mol$ | D. | $\frac{w(A-X-N)}{A}mol$ |
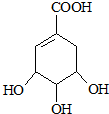
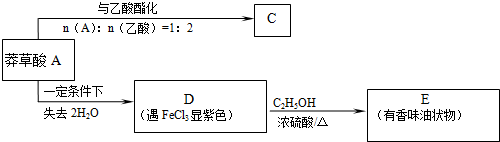
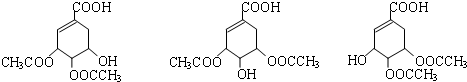 .
.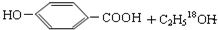 $→_{△}^{浓硫酸}$
$→_{△}^{浓硫酸}$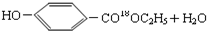 ②E与足量的NaOH溶液反应
②E与足量的NaOH溶液反应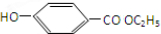 +2NaOH→
+2NaOH→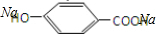 +H2O.
+H2O. 现有常温时浓度相同的五种电解质溶液:①CH3COOH ②Na2CO3 ③HNO3④CH3COONa ⑤NaOH
现有常温时浓度相同的五种电解质溶液:①CH3COOH ②Na2CO3 ③HNO3④CH3COONa ⑤NaOH