题目内容
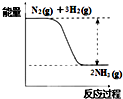
16.下列反应属于放热反应的是( )| A. | 氯化铵与八水合氢氧化钡反应 | |
| B. | 碳与水蒸气高温制取水煤气 | |
| C. | 氢氧化钾和硫酸中和 | |
| D. | 碳酸钙高温分解成氧化钙和二氧化碳 |
分析 根据常见的放热反应有:所有的物质燃烧、所有金属与酸反应、金属与水反应,所有中和反应;绝大多数化合反应和铝热反应;
常见的吸热反应有:绝大数分解反应,个别的化合反应(如C和CO2),少数分解置换以及某些复分解(如铵盐和强碱),C或氢气做还原剂时的反应.
解答 解:A、氯化铵与八水合氢氧化钡反应属于吸热反应,故A错误;
B、碳与水蒸气高温制取水煤气的反应是吸热反应,故B错误;
C、氢氧化钾和硫酸的中和反应是放热反应,故C正确;
D、碳酸钙高温分解成氧化钙和二氧化碳的反应是吸热反应,故D错误.
故选C.
点评 本题考查放热反应,抓住中学化学中常见的吸热或放热的反应是解题的关键,对于特殊过程中的热量变化的要熟练记忆来解答此类习题,题目难度不大.

练习册系列答案
 新非凡教辅冲刺100分系列答案
新非凡教辅冲刺100分系列答案
相关题目
15. 有A、B、C、D、E五种元素.其相关信息如下:
有A、B、C、D、E五种元素.其相关信息如下:
回答下列问题.
(1)写出E元素原子基态时M层的电子排布式3s23p63d10
(2)C元素单质分子中含有δ和π键的键数之比为1:2.
(3)解释在水中的溶解度C7H15OH比乙醇低的原因是:乙醇中的羟基与水的羟基结构相似所以溶解度大,C7H15OH中烃基大,与水的羟基结构相似程度小所以溶解度小:
(4)A、C、E三种元素可形成:E(CA3)42+配离子,其中存在的化学键类型有①③(填序号):
①配位键 ②金属键 ③极性共价键 ④非极性共价键 ⑤离子键 ⑥氢键
若 E(CA3)42+具有对称的空间构型.且当 E(CA3)42+中的两个CA3分子被两个Cl取代时.能得到两种不同结构的产物,则 E(CA3)42+的空间构型为a(填序号).
a.平面正方形b.正四面体 c.三角锥型 d.V型
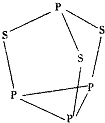
(5)三硫化四磷是黄绿色针状结晶,其结构如图所示.
三硫化四磷分子中P原子采取sp3杂化,与PO3-互为等电子体的化合物分子的化学式为SO3.用NA表示阿伏加德罗常数的数值,0.1mol三硫化四磷分子中含有的孤电子对数为NA.
 有A、B、C、D、E五种元素.其相关信息如下:
有A、B、C、D、E五种元素.其相关信息如下:| 元素 | 相关信息 |
| A | A元素的一种原子没有中子,只有一个质子 |
| B | B是电负性最大的元素 |
| C | C的基态原子2p轨道有三个未成对电子 |
| D | D为主族元素,且与E同周期,其最外层上有两个运动状态不同的电子 |
| E | E能形成砖红色(红色)的E2O和EO两种氧化物 |
(1)写出E元素原子基态时M层的电子排布式3s23p63d10
(2)C元素单质分子中含有δ和π键的键数之比为1:2.
(3)解释在水中的溶解度C7H15OH比乙醇低的原因是:乙醇中的羟基与水的羟基结构相似所以溶解度大,C7H15OH中烃基大,与水的羟基结构相似程度小所以溶解度小:
(4)A、C、E三种元素可形成:E(CA3)42+配离子,其中存在的化学键类型有①③(填序号):
①配位键 ②金属键 ③极性共价键 ④非极性共价键 ⑤离子键 ⑥氢键
若 E(CA3)42+具有对称的空间构型.且当 E(CA3)42+中的两个CA3分子被两个Cl取代时.能得到两种不同结构的产物,则 E(CA3)42+的空间构型为a(填序号).
a.平面正方形b.正四面体 c.三角锥型 d.V型
(5)三硫化四磷是黄绿色针状结晶,其结构如图所示.
三硫化四磷分子中P原子采取sp3杂化,与PO3-互为等电子体的化合物分子的化学式为SO3.用NA表示阿伏加德罗常数的数值,0.1mol三硫化四磷分子中含有的孤电子对数为NA.
11.NA代表阿伏加德罗常数的值,下列叙述正确的是( )
| A. | 常温常压下,2.24L氯气与水反应,转移的电子数为0.2NA | |
| B. | 钠在空气中燃烧可生成多种氧化物,23g钠充分燃烧时转移电子数为1NA | |
| C. | 18gD2O和18gH2O中含有的质子数均为10NA | |
| D. | 标准状况下,11.2L三氧化硫所含分子数为0.5NA |
1.短周期元素X和元素Y位于不同的周期,元素X原子的最外层电子数为a,次外层电子数为b;元素Y原子的M层电子数为(a-b),L层电子数为(a+b),则关于X、Y两元素形成的化合物的说法正确的是( )
| A. | 属于两性氧化物 | B. | 能与氢氧化钠反应 | ||
| C. | 能与硫酸反应 | D. | 常温下能溶于水 |
 在已经发现的一百多种元素中,除稀有气体外,非金属元素只有十多种,但与生产生活有密切的联系.
在已经发现的一百多种元素中,除稀有气体外,非金属元素只有十多种,但与生产生活有密切的联系.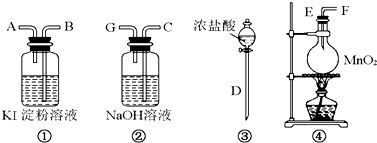
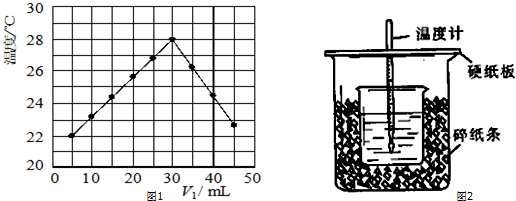
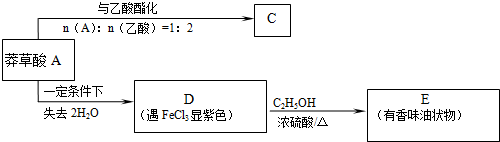
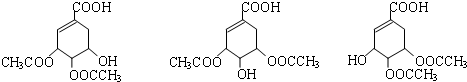 .
.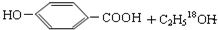 $→_{△}^{浓硫酸}$
$→_{△}^{浓硫酸}$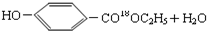 ②E与足量的NaOH溶液反应
②E与足量的NaOH溶液反应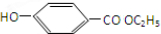 +2NaOH→
+2NaOH→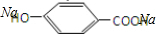 +H2O.
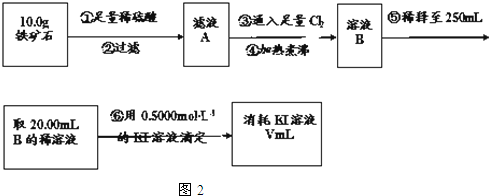
+H2O.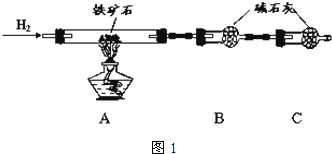 铁矿石是工业炼铁的主要原料之一,其主要成分为铁的氧化物(设杂质中不含铁元素和氧元素,且杂质不与H2SO4反应).某研究性学习小组对某铁矿石中铁的氧化物的化学式进行探究.
铁矿石是工业炼铁的主要原料之一,其主要成分为铁的氧化物(设杂质中不含铁元素和氧元素,且杂质不与H2SO4反应).某研究性学习小组对某铁矿石中铁的氧化物的化学式进行探究.