题目内容
17.过氧化钙(CaO2)难溶于水,广泛应用于渔业、农业、环保等许多方面.I.CaO2的制备:
(1)①在低温下,往过氧化氢浓溶液中投入无水氯化钙发生复分解反应,写出该可逆反应的化学方程式H2O2+CaCl2
 CaO2+2HCl.
CaO2+2HCl.②为控制低温的方式,最好将反应器放置在冰水浴中.
③测得不同温度下,过氧化钙的平均生成速率如下表所示:
| 温度(℃) | 20 | 30 | 40 | 50 | 60 | 70 | 80 |
| CaO2平均生成速率(×10-3mol.s-1) | 7.5 | 8.2 | 9.4 | 8.0 | 7.1 | 6.7 | 5.5 |
(2)一段时间后,再加入氨水,当调节溶液pH至9~11,才出现大量沉淀.用简要的文字解释需用氨水调节pH至9~11的原因NH3•H2O结合HCl,使反应H2O2+CaCl2
 CaO2+2HCl平衡向正方向移动,提高过氧化钙的产量.
CaO2+2HCl平衡向正方向移动,提高过氧化钙的产量.II.CaO2的热稳定性:CaO2在一定温度下能发生可逆反应,生成CaO和O2.
(3)标准生成热的定义为:在某温度下,由处于标准状态的各种元素的最稳定的单质生成标准状态下1mol某纯物质的热效应.已知,CaO2和CaO的标准生成热分别为a kJ•mol-1和b kJ•mol-1,请书写CaO2分解生成CaO和O2的热化学方程式2CaO2(s)
 2CaO(s)+O2(g)△H=2(b-a)kJ•mol-1.
2CaO(s)+O2(g)△H=2(b-a)kJ•mol-1.(4)一定温度下,在2L的恒容容器中进行该反应,反应过程中各物质的物质的量如下表所示:
| 时间/s | n(CaO2)/mol | n(CaO)/mol | n(O2)/mol |
| 0 | 2 | 0 | 0 |
| 1 | 1.4 | 0.6 | 0.3 |
| 2 | 1 | 1 | 0.5 |
| 3 | 1 | 1 | 0.5 |
(5)3s时,若对该容器压缩体积,其它条件不变,则当再次达到平衡时,氧气的浓度不变(填“变大”、“变小”、“不变”、“无法确定”),理由是温度不变,该反应的平衡常数K=c(CO2)=0.25mol/L不变.
(6)下列说法不能说明该反应达到平衡的是a(填字母).
a.气体的密度不再改变 b.固体质量不再改变
c.正反应速率不再改变 d.逆反应速率不再改变.
分析 I.(1)①在低温下,往过氧化氢浓溶液中投入无水氯化钙发生复分解反应生成CaO2与HCl;
②为控制低温,最好将反应器放置在冰水浴中;
③40℃之前,温度升高,速率加快;40℃之后,温度继续升高,双氧水分解;
(2)NH3•H2O结合反应生成HCl,使平衡向正方向移动;
II.(3)由标准生成热可得热化学方程式:①Ca(s)+O2(g)=CaO2(s)△H=a kJ•mol-1,
②Ca(s)+$\frac{1}{2}$O2(g)=CaO(s)△H=b kJ•mol-1,
根据盖斯定律,(②-①)×2可得:2CaO2(s)  2CaO(s)+O2(g);
2CaO(s)+O2(g);
(4)发生反应:2CaO2(s)  2CaO(s)+O2(g),2s、3s时,同一组分的物质的量不变,说明2s时反应得到平衡,平衡常数K=c(O2);
2CaO(s)+O2(g),2s、3s时,同一组分的物质的量不变,说明2s时反应得到平衡,平衡常数K=c(O2);
(5)温度不变,该反应的平衡常数K=c(CO2)不变;
(6)可逆反应到达平衡时,同种物质的正逆速率相等且保持不变,各组分的浓度、含量保持不变,由此衍生的其它一些量不变,判断平衡的物理量应随反应进行发生变化,该物理量由变化到不再变化说明到达平衡.
解答 解:I.(1)①在低温下,往过氧化氢浓溶液中投入无水氯化钙发生复分解反应生成CaO2与HCl,反应方程式为:H2O2+CaCl2  CaO2+2HCl,
CaO2+2HCl,
故答案为:H2O2+CaCl2  CaO2+2HCl;
CaO2+2HCl;
②为控制低温,最好将反应器放置在冰水浴中,
故答案为:冰水浴;
③40℃之前,温度升高,速率加快;40℃之后,温度继续升高,双氧水分解,浓度下降,反应速率减慢,
故答案为:40℃之前,温度升高,速率加快;40℃之后,温度继续升高,双氧水分解,浓度下降,反应速率减慢;
(2)NH3•H2O结合HCl,使反应H2O2+CaCl2 CaO2+2HCl平衡向正方向移动,提高过氧化钙的产量,
CaO2+2HCl平衡向正方向移动,提高过氧化钙的产量,
故答案为:NH3•H2O结合HCl,使反应H2O2+CaCl2 CaO2+2HCl平衡向正方向移动,提高过氧化钙的产量;
CaO2+2HCl平衡向正方向移动,提高过氧化钙的产量;
II.(3)由标准生成热可得热化学方程式:①Ca(s)+O2(g)=CaO2(s)△H=a kJ•mol-1,
②Ca(s)+$\frac{1}{2}$O2(g)=CaO(s)△H=b kJ•mol-1,
根据盖斯定律,(②-①)×2可得:2CaO2(s) 2CaO(s)+O2(g)△H=2(b-a)kJ•mol-1,
2CaO(s)+O2(g)△H=2(b-a)kJ•mol-1,
故答案为:2CaO2(s) 2CaO(s)+O2(g)△H=2(b-a)kJ•mol-1;
2CaO(s)+O2(g)△H=2(b-a)kJ•mol-1;
(4)发生反应:2CaO2(s)  2CaO(s)+O2(g),2s、3s时,同一组分的物质的量不变,说明2s时反应得到平衡,平衡常数K=c(O2)=$\frac{0.5mol}{2L}$=0.25mol/L,
2CaO(s)+O2(g),2s、3s时,同一组分的物质的量不变,说明2s时反应得到平衡,平衡常数K=c(O2)=$\frac{0.5mol}{2L}$=0.25mol/L,
故答案为:0.25mol/L;
(5)温度不变,该反应的平衡常数K=c(CO2)=0.25mol/L不变,故氧气的浓度不变,
故答案为:不变;温度不变,该反应的平衡常数K=c(CO2)=0.25mol/L不变;
(6)a.反应体系中只有氧气为气体,恒温恒容条件下,随反应进行容器内气体密度增大,气体的密度保持不变,说明反应到达平衡,但若在恒温恒压下条件下,氧气的密度不变,故a错误;
b.反应有氧气生成,随反应进行固体质量减小,而固体质量不再改变,说明反应到达平衡,故b正确;
c.可能反应到达平衡时只能反应速率相等,不再变化,故c正确;
d.可能反应到达平衡时只能反应速率相等,不再变化,故d正确.
故选:a.
点评 本题以过氧化钙的制备为载体,考查对制备原理的分析与评价、化学平衡计算与影响因素、平衡状态判断、热化学方程式书写、陌生方程式书写等,是对学生综合能力的考查.

 华东师大版一课一练系列答案
华东师大版一课一练系列答案(1)将称量好的4.3g烧碱样品配制成250mL待测液,配制过程使用的主要仪器除250mL容量瓶、量筒、烧杯、胶头滴管外,还有一种必须使用的仪器是玻璃棒.
(2)用碱式滴定管量取10.00mL待测液于锥形瓶中,滴入几滴酚酞.
(3)用0.20mol•L-1的标准盐酸滴定待测液,判断滴定终点的现象是:滴入最后一滴盐酸时,锥形瓶内溶液恰好由红色变无色,并且半分钟内不变色.
(4)如果实验操作正确,从滴定开始到结束,溶液中的离子浓度关系可以出现的是B、C(填答案字母序号)
A.c(Na+)>c(Cl-)>c(H+)>c(OH-)
B.c(Na+)>c(OH-)>c(Cl-)>c(H+)
C.c(Na+)+c(H+)=c(OH-)+c(Cl-)
D.c(Na+)+c(H+)>c(OH-)+c(Cl-)
(5)根据下列数据计算,c(NaOH)=0.40mol/L,烧碱的纯度为93%(保留整数)
| 滴定次数 | 待测液体积(mL) | 标准盐酸体积(mL) | |
| 滴定前读数(mL) | 滴定后读数(mL) | ||
| 第一次 | 10.00 | 0.50 | 20.40 |
| 第二次 | 10.00 | 4.00 | 24.10 |
A.滴定前平视,滴定后俯视 B.用标准液润洗滴定管
C.用待测液润洗锥形瓶 D.不小心将标准液滴在锥形瓶外面
E.滴定接近终点时,用少量蒸馏水冲洗锥形瓶内.
 在已经发现的一百多种元素中,除稀有气体外,非金属元素只有十多种,但与生产生活有密切的联系.
在已经发现的一百多种元素中,除稀有气体外,非金属元素只有十多种,但与生产生活有密切的联系.
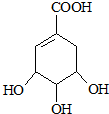
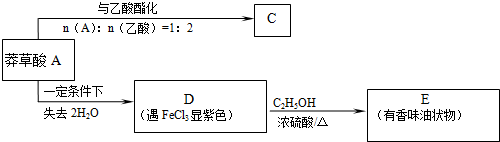
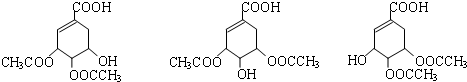 .
.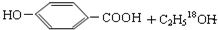 $→_{△}^{浓硫酸}$
$→_{△}^{浓硫酸}$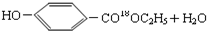 ②E与足量的NaOH溶液反应
②E与足量的NaOH溶液反应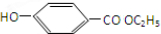 +2NaOH→
+2NaOH→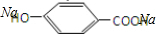 +H2O.
+H2O.
 .
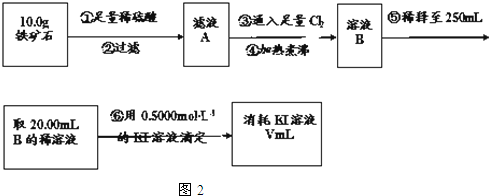
.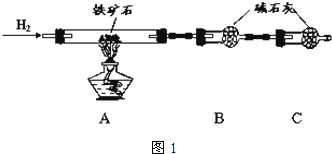 铁矿石是工业炼铁的主要原料之一,其主要成分为铁的氧化物(设杂质中不含铁元素和氧元素,且杂质不与H2SO4反应).某研究性学习小组对某铁矿石中铁的氧化物的化学式进行探究.
铁矿石是工业炼铁的主要原料之一,其主要成分为铁的氧化物(设杂质中不含铁元素和氧元素,且杂质不与H2SO4反应).某研究性学习小组对某铁矿石中铁的氧化物的化学式进行探究.