题目内容
13.某化学课外兴趣小组为探究铜跟浓硫酸的反应情况,用如图所示装置进行有关实验.请回答: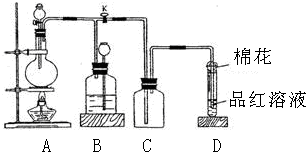
(1)装置A中发生的化学反应方程式为2H2SO4(浓)+Cu$\frac{\underline{\;加热\;}}{\;}$CuSO4+2H2O+2SO2↑.
(2)装置D中试管口放置的棉花中应浸一种液体,这种液体是氢氧化钠溶液等碱性溶液,其作用是吸收多余的二氧化硫,防止污染空气.
(3)装置B的作用是贮存多余的气体.当D处有明显的现象后,关闭旋塞K并移去酒精灯,但由于余热的作用,A处仍有气体产生,此时B中现象是瓶中液面下降,长颈漏斗中液面上升;.B中应放置的液体是(填字母)d.
a.水 b.酸性KMnO4溶液 c.浓溴水 d.饱和NaHSO3溶液
(4)实验中,取一定质量的铜片和一定体积18mol•L-1的浓硫酸放在圆底烧瓶中共热,直到反应完毕,发现烧瓶中还有铜片剩余,该小组学生根据所学的化学知识认为还有一定量的硫酸剩余.
①有一定量的余酸但未能使铜片完全溶解,你认为原因是反应过程中浓硫酸被消耗,逐渐变稀,而铜不和稀硫酸反应.
②下列药品中能用来证明反应结束后的烧瓶中确有余酸的是ad(填字母).
a.铁粉 b.BaCl2溶液 c.银粉 d.NaHCO3溶液.
分析 (1)加热条件下,Cu和浓硫酸反应生成硫酸铜、二氧化硫和水;
(2)二氧化硫属于酸性氧化物且有毒,不能直接排空,可以用碱液吸收;
(3)装置B通过长颈漏斗中液面变化贮存二氧化硫;B为气体贮存装置时,盛放的液体不能和二氧化硫反应;
(4)①从浓硫酸随着反应进行浓度变稀,铜不和稀硫酸发生反应分析;
②证明有酸剩余是验证稀硫酸的存在关键是氢离子的检验.
解答 解:(1)加热条件下,Cu和浓硫酸反应生成硫酸铜、二氧化硫和水,反应方程式为2H2SO4(浓)+Cu$\frac{\underline{\;加热\;}}{\;}$CuSO4+2H2O+2SO2↑,
故答案为:2H2SO4(浓)+Cu$\frac{\underline{\;加热\;}}{\;}$CuSO4+2H2O+2SO2↑;
(2)二氧化硫属于酸性氧化物且有毒,不能直接排空,可以用碱液吸收,所以棉花蘸取的溶液可以为NaOH溶液等碱性溶液;其作用是吸收多余的二氧化硫,防止二氧化硫溢出而污染大气,
故答案为:氢氧化钠溶液等碱性溶液;吸收多余的二氧化硫,防止污染空气;
(3)当D处有明显的现象后,关闭旋塞K,移去酒精灯,但由于余热的作用,A处仍有气体产生,导致B中气体压强增大,气压使B中液体通过长颈漏斗液面上升,从而减小压强,防止安全事故发生,此时B中现象是瓶中液面下降,长颈漏斗中液面上升;
B装置的作用是贮存气体,所以B中盛放液体不能和二氧化硫反应,
水、酸性高锰酸钾及NaOH都能和二氧化硫反应,只有亚硫酸氢钠和二氧化硫不反应,故选d;
故答案为:瓶中液面下降,长颈漏斗中液面上升;d;
(4)①一定质量的铜片和一定体积18mol•L-1的浓硫酸放在圆底烧瓶中共热,浓硫酸随着反应进行,浓度变小成为稀硫酸,稀硫酸不再和铜发生反应,所以有一定量的余酸但未能使用铜片完全溶解,
故答案为:反应过程中浓硫酸被消耗,逐渐变稀,而铜不和稀硫酸反应;
②能用来证明反应结束后的烧瓶中确有余酸,实质证明氢离子的存在,
a.铁粉与稀硫酸反应放气体,可以证明稀硫酸有剩余,故a正确;
b.BaCl2溶液加入后出现白色沉淀,但因为生成产物中有硫酸铜生成,也可以生成白色沉淀,故不能证明稀硫酸有剩余,故b错误;
c.银粉不与稀硫酸反应,不能证明稀硫酸有剩余,故c错误;
d.NaHCO3溶液会与稀硫酸反应发出二氧化碳气体,可以证明稀硫酸有剩余,故d正确;
故答案为:ad.
点评 本题考查了浓硫酸的性质应用,题目难度中等,涉及反应产物的验证、测定方法的设定和判断,关键是产物中的二氧化硫性质的应用,试题培养了学生的分析能力及化学实验能力.

 星级口算天天练系列答案
星级口算天天练系列答案①水玻璃 ②水泥 ③普通玻璃 ④漂白粉 ⑤Na2CO3•10H2O ⑥氯水 ⑦液氯 ⑧纯净的盐酸.
| A. | ①④ | B. | ①⑤⑦⑧ | C. | ①⑤⑥ | D. | ⑤⑦ |
| A. | 属于两性氧化物 | B. | 能与氢氧化钠反应 | ||
| C. | 能与硫酸反应 | D. | 常温下能溶于水 |
| X | ||
| M |
(2)X元素的最高价氧化物的电子式为
 ;
;(3)元素的非金属性:M<Q(填“>”、“<”或“=”),写出一个证明此结论的化学方程式H2S+Cl2=2S↓+2HCl;
(4)Z与W形成的4核10个电子离子的电子式为
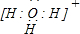 ;
;(5)X、Y可分别与Z以原子个数比1:1形成化合物丙和丁.在催化剂存在条件下,丙与丁发生反应,生成单质Y2和另一种化合物戊.写出该反应的化学方程式:2CO+2NO$\frac{\underline{\;催化剂\;}}{\;}$N2+2CO2.
(1)将称量好的4.3g烧碱样品配制成250mL待测液,配制过程使用的主要仪器除250mL容量瓶、量筒、烧杯、胶头滴管外,还有一种必须使用的仪器是玻璃棒.
(2)用碱式滴定管量取10.00mL待测液于锥形瓶中,滴入几滴酚酞.
(3)用0.20mol•L-1的标准盐酸滴定待测液,判断滴定终点的现象是:滴入最后一滴盐酸时,锥形瓶内溶液恰好由红色变无色,并且半分钟内不变色.
(4)如果实验操作正确,从滴定开始到结束,溶液中的离子浓度关系可以出现的是B、C(填答案字母序号)
A.c(Na+)>c(Cl-)>c(H+)>c(OH-)
B.c(Na+)>c(OH-)>c(Cl-)>c(H+)
C.c(Na+)+c(H+)=c(OH-)+c(Cl-)
D.c(Na+)+c(H+)>c(OH-)+c(Cl-)
(5)根据下列数据计算,c(NaOH)=0.40mol/L,烧碱的纯度为93%(保留整数)
| 滴定次数 | 待测液体积(mL) | 标准盐酸体积(mL) | |
| 滴定前读数(mL) | 滴定后读数(mL) | ||
| 第一次 | 10.00 | 0.50 | 20.40 |
| 第二次 | 10.00 | 4.00 | 24.10 |
A.滴定前平视,滴定后俯视 B.用标准液润洗滴定管
C.用待测液润洗锥形瓶 D.不小心将标准液滴在锥形瓶外面
E.滴定接近终点时,用少量蒸馏水冲洗锥形瓶内.
| A. | K+、Na+、NO3-、SO42- | B. | Mg2+、K+、NO3-、Cl- | ||
| C. | Na+、Fe2+、NO3-、Cl- | D. | Ba2+、H+、Cl-、SO42- |
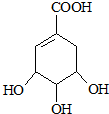
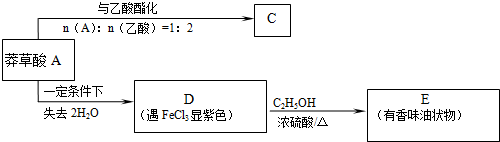
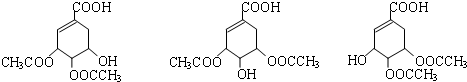 .
.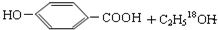 $→_{△}^{浓硫酸}$
$→_{△}^{浓硫酸}$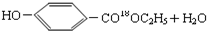 ②E与足量的NaOH溶液反应
②E与足量的NaOH溶液反应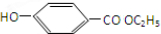 +2NaOH→
+2NaOH→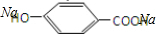 +H2O.
+H2O.