题目内容
18.已知:Na2CO3•10H2O(s)=Na2CO3(s)+10H2O(g)△H1=+532.4kJ•mol-1Na2CO3•10H2O(s)=Na2CO3•2H2O(s)+8H2O(g)△H2=+373.6kJ•mol-1
H2O(g)=H2O(l)△H3=-44kJ•mol-1
写出Na2CO3•2H2O脱水分解后生成碳酸钠固体和液态水的热化学方程式Na2CO3•2H2O(s)═Na2CO3(s)+2H2O(l);△H=+70.8KJ/mol.
分析 依据热化学方程式和盖斯定律计算得到所需要的热化学方程式.
解答 解:①Na2CO3•10H2O(s)═Na2CO3(s)+10H2O(g)△H1=+532.36kJ•mol-1
②Na2CO3•10H2O(s)═Na2CO3•H2O(s)+9H2O(g)△H2=+373.6kJ•mol-1
③H2O(g)=H2O(l)△H3=-44kJ•mol-1
由盖斯定律①-②+③得到:Na2CO3•2H2O(s)═Na2CO3(s)+2H2O(l);△H=+70.8KJ/mol,
故答案为:Na2CO3•2H2O(s)═Na2CO3(s)+2H2O(l);△H=+70.8KJ/mol.
点评 本题考查了热化学方程式的书写和盖斯定律的计算应用,题目较简单.

练习册系列答案
 品学双优卷系列答案
品学双优卷系列答案 小学期末冲刺100分系列答案
小学期末冲刺100分系列答案
相关题目
9.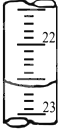 某学生用0.2000mol•L-1的标准NaOH溶液滴定未知浓度的盐酸,其操作步骤如下:
某学生用0.2000mol•L-1的标准NaOH溶液滴定未知浓度的盐酸,其操作步骤如下:
①用蒸馏水洗涤碱式滴定管,并立即注入NaOH溶液至“0”刻度以上
②固定好滴定管并使滴定管尖嘴充满液体
③调节液面至“0”或“0”刻度线稍下,并记下读数
④移取20.00mL待测液注入洁净的锥形瓶中,并加入2滴酚酞溶液
⑤用标准液滴定至终点,记下滴定管液面读数.
填空:(1)以上步骤有错误的是①(填编号),该错误操作会导致测定结果偏大.(填“偏大”、“偏小”或“无影响”)
(2)步骤⑤中,在记录滴定管液面读数时,滴定管尖嘴有气泡,导致测定结果偏小.(填“偏大”、“偏小”或“无影响”)
(3)判断滴定终点的现象是:无色变为粉红,半分钟内不变色;
(4)如图是某次滴定时的滴定管中的液面,其读数为22.60mL
(5)根据下列数据:请计算待测盐酸溶液的浓度:0.2000mol•L-1
 某学生用0.2000mol•L-1的标准NaOH溶液滴定未知浓度的盐酸,其操作步骤如下:
某学生用0.2000mol•L-1的标准NaOH溶液滴定未知浓度的盐酸,其操作步骤如下:①用蒸馏水洗涤碱式滴定管,并立即注入NaOH溶液至“0”刻度以上
②固定好滴定管并使滴定管尖嘴充满液体
③调节液面至“0”或“0”刻度线稍下,并记下读数
④移取20.00mL待测液注入洁净的锥形瓶中,并加入2滴酚酞溶液
⑤用标准液滴定至终点,记下滴定管液面读数.
填空:(1)以上步骤有错误的是①(填编号),该错误操作会导致测定结果偏大.(填“偏大”、“偏小”或“无影响”)
(2)步骤⑤中,在记录滴定管液面读数时,滴定管尖嘴有气泡,导致测定结果偏小.(填“偏大”、“偏小”或“无影响”)
(3)判断滴定终点的现象是:无色变为粉红,半分钟内不变色;
(4)如图是某次滴定时的滴定管中的液面,其读数为22.60mL
(5)根据下列数据:请计算待测盐酸溶液的浓度:0.2000mol•L-1
| 滴定次数 | 待测液 体积(mL) | 标准烧碱体积(mL) | |
| 滴定前读数 | 滴定后读数 | ||
| 第一次 | 20.00 | 0.40 | 20.40 |
| 第二次 | 20.00 | 4.00 | 24.00 |
| 第三次 | 20.00 | 2.00 | 24.10 |
6.下列有关说法正确的是( )
| A. | CaCO3(s)=CaO(s)+CO2(g)室温下不能自发进行,说明该反应的△H<0 | |
| B. | FeCl3和MnO2均可加快H2O2分解,同等条件下二者对H2O2分解速率的改变不同 | |
| C. | N2(g)+3H2(g)?2NH3(g)△H<0,其他条件不变时升高温度,反应速率V(H2)和氢气的平衡转化率均增大 | |
| D. | 水的离子积常数Kw随着温度的升高而增大,说明水的电离是放热反应 |
13.已知反应:①2C(s)+O2(g)=2CO(g)△H=-221kJ/mol
②稀溶液中,H+(aq)+OH-(aq)=H2O(l)△H=-57.3kJ/mol
下列结论正确的是( )
②稀溶液中,H+(aq)+OH-(aq)=H2O(l)△H=-57.3kJ/mol
下列结论正确的是( )
| A. | 碳的燃烧热为△H=-110.5 kJ/mol | |
| B. | 1molC(s)所具有的能量一定高于1molCO(g)所具有的能量 | |
| C. | 稀硫酸与稀NaOH溶液反应的中和热为△H=-57.3 kJ/mol | |
| D. | 稀醋酸与稀NaOH溶液反应生成1 mol水,也放出57.3 kJ 热量 |
3.已知X、Y、Z为三种原子序数相连的元素,最高价氧化物对应水化物的酸性相对强弱是:HXO4>H2YO4>H3ZO4.则下列说法不正确的是( )
| A. | 气态氢化物的稳定性:HX>H2Y>ZH3 | B. | 非金属活泼性:Y<X<Z | ||
| C. | 单质的氧化性:X2>Y>Z | D. | 原子最外电子层上电子数不相等 |
10.已知X、Y、Z三种醇互为同系物,则建立在假设基础上的推断正确的是( )
| 假设 | 推断 | |
| A | 若X、Y均能发生消去反应 | Z一定能发生消去反应 |
| B | 若X是白酒的主要成分 | Y可能是丙三醇 |
| C | 若X、Y分子中分别有1个、2个碳原子 | Z的摩尔质量不小于60 g•mol-1 |
| D | 若X、Y均存在醇类同分异构体 | Z一定存在醇类同分异构体 |
| A. | A | B. | B | C. | C | D. | D |
7.下列各组中的反应,属于同一反应类型的是( )
| A. | 由溴丙烷水解制丙醇;由丙烯与水反应制丙醇 | |
| B. | 由甲苯硝化制对硝基甲苯;由甲苯氧化制苯甲酸 | |
| C. | 由氯代环己烷制环己烯;由丙烯制1,2-二溴丙烷 | |
| D. | 由乙烯制聚乙烯;由1,3-丁二烯合成顺丁橡胶 |
 ;
; ,G元素形成的单质的结构式为Cl-Cl.
,G元素形成的单质的结构式为Cl-Cl. .
. .
.