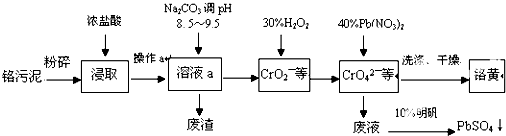
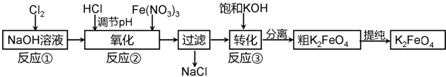
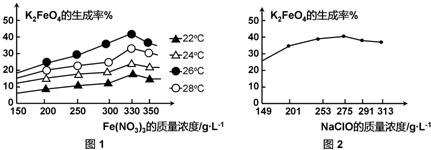
题目内容
某校化学兴趣小组用如图所示过程除去AlCl3中含有的Mg2+、K+杂质离子并尽可能减少AlCl3的损失.请回答下列问题:

(1)写出混合物中加入足量氢氧化钠溶液时,溶液中发生反应的离子方程式: 、 .
(2)氢氧化钠溶液能否用氨水代替, ,理由 .
(3)溶液a中存在的离子有 ;在溶液a中加入盐酸时需控制盐酸的量,为什么? ;为此,改进方法是 .

(1)写出混合物中加入足量氢氧化钠溶液时,溶液中发生反应的离子方程式:
(2)氢氧化钠溶液能否用氨水代替,
(3)溶液a中存在的离子有
考点:物质分离和提纯的方法和基本操作综合应用
专题:实验设计题
分析:由实验流程可知,加足量的NaOH生成氢氧化镁沉淀,溶液a中含AlO2-、K+、Cl-、Na+、OH-,然后加盐酸,沉淀c为氢氧化铝,和盐酸反应生成氯化铝,溶液b中含KCl、NaCl,以此来解答.
(1)镁离子和氢氧化钠反应生成氢氧化镁沉淀,铝离子和足量的氢氧化钠反应生成偏铝酸钠和水,据此书写离子方程式;
(2)氨水和镁离子、铝离子均生成沉淀,无法把二者分开;
(3)根据发生的反应判断a溶液中存在离子,由于氢氧化铝为两性氢氧化物,能溶于强酸,故最佳方案是通入二氧化碳气体,氢氧化铝不溶于二氧化碳溶液中.
(1)镁离子和氢氧化钠反应生成氢氧化镁沉淀,铝离子和足量的氢氧化钠反应生成偏铝酸钠和水,据此书写离子方程式;
(2)氨水和镁离子、铝离子均生成沉淀,无法把二者分开;
(3)根据发生的反应判断a溶液中存在离子,由于氢氧化铝为两性氢氧化物,能溶于强酸,故最佳方案是通入二氧化碳气体,氢氧化铝不溶于二氧化碳溶液中.
解答:
解:由实验流程可知,加足量的NaOH生成氢氧化镁沉淀,过滤得到溶液a中含AlO2-、K+、Cl-、Na+、OH-,然后加盐酸,沉淀c为氢氧化铝,加盐酸生成氯化铝,溶液b中含KCl、NaCl;
(1)混合物中镁离子和铝离子和氢氧化钠反应,镁离子生成氢氧化镁沉淀,反应的离子方程式为:Mg2++2OH-=Mg(OH)2↓,铝离子和足量的氢氧化钠反应生成偏铝酸钠和水,反应的离子方程式为:Al3++4OH-=2H2O+AlO2-,故答案为:Mg2++2OH-=Mg(OH)2↓;Al3++4OH-=2H2O+AlO2-;
(2)用氨水,则Mg2+、Al3+均转化为沉淀,不能分离,则不能用氨水代替NaOH,
故答案为:否;用氨水,则Mg2+、Al3+均转化为沉淀,不能分离;
(3)Al3+与过量NaOH反应,溶液a中含AlO2-、K+、Cl-、Na+、OH-,向溶液a中加入盐酸,生成氢氧化铝沉淀,因氢氧化铝能溶于盐酸,则向溶液a中滴加盐酸需控制溶液的pH,向溶液a中加入试剂X的最佳方案是通入过量的二氧化碳生成氢氧化铝沉淀和碳酸氢钠,过滤得到氢氧化铝固体,反应的离子方程式为:CO2+AlO2-+2H2O=Al(OH)3↓+HCO3-,
故答案为:AlO2-、K+、Cl-、Na+、OH-;因氢氧化铝能溶于盐酸,则向溶液a中滴加盐酸需控制溶液的pH;通入过量的二氧化碳.
(1)混合物中镁离子和铝离子和氢氧化钠反应,镁离子生成氢氧化镁沉淀,反应的离子方程式为:Mg2++2OH-=Mg(OH)2↓,铝离子和足量的氢氧化钠反应生成偏铝酸钠和水,反应的离子方程式为:Al3++4OH-=2H2O+AlO2-,故答案为:Mg2++2OH-=Mg(OH)2↓;Al3++4OH-=2H2O+AlO2-;
(2)用氨水,则Mg2+、Al3+均转化为沉淀,不能分离,则不能用氨水代替NaOH,
故答案为:否;用氨水,则Mg2+、Al3+均转化为沉淀,不能分离;
(3)Al3+与过量NaOH反应,溶液a中含AlO2-、K+、Cl-、Na+、OH-,向溶液a中加入盐酸,生成氢氧化铝沉淀,因氢氧化铝能溶于盐酸,则向溶液a中滴加盐酸需控制溶液的pH,向溶液a中加入试剂X的最佳方案是通入过量的二氧化碳生成氢氧化铝沉淀和碳酸氢钠,过滤得到氢氧化铝固体,反应的离子方程式为:CO2+AlO2-+2H2O=Al(OH)3↓+HCO3-,
故答案为:AlO2-、K+、Cl-、Na+、OH-;因氢氧化铝能溶于盐酸,则向溶液a中滴加盐酸需控制溶液的pH;通入过量的二氧化碳.
点评:本题考查混合物分离、提纯实验方案的设计,为高频考点,把握实验流程中发生的反应为解答的关键,侧重分析与实验能力的考查,注意氢氧化铝的两性,题目难度不大.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
有些电影、电视剧中的仙境美轮美奂,这些神话仙境中所需的烟雾是在放于温热石棉网上的NH4NO3和Zn粉的混合物中滴几滴水后产生的白烟:NH4NO3+Zn=ZnO+N2↑+2H2O,下列有关说法中正确的是( )
| A、该反应中NH4NO3只作氧化剂 |
| B、ZnO是还原产物 |
| C、水在反应中可能起催化作用 |
| D、每生成1mol N2共转移8mol电子 |
下列有关说法正确的是( )
| A、1H、D+、T2互为同位素 |
| B、H2O、CH3COOH、NH4HCO3都是电解质 |
| C、铝、铁、铜三者对应的氧化物均为碱性氧化物 |
| D、有单质参加的反应一定是氧化还原反应 |
下列关于蛋白质在人体中的新陈代谢的认识不正确的是( )
| A、蛋白质溶液里加(NH4)2SO4溶液可提纯蛋白质 |
| B、在豆浆中加入少量石膏能使豆浆凝结为豆腐 |
| C、温度越高,酶对某些化学反应的催化效率越高 |
| D、鉴别某纺织物成分是蛋白丝还是人造丝,可采用灼烧闻气味的方法 |