题目内容
铬酸铅(PbCrO4)俗称铬黄,不溶于水.广泛用于涂料、油墨、漆布、塑料和文教用品等工业.实验室模拟工业上用铬污泥(含有Cr2O3、Fe2O3、Al2O3、SiO2等)制备铬黄的工艺流程如下:
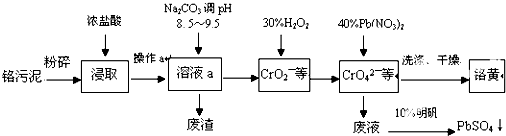
(1)将铬污泥粉碎的目的是 .
(2)废渣的主要成分是Al(OH)3和Fe(OH)3.已知25℃时,Al(OH)3的Ksp=1.3×10-33,则该温度下反应Al3++3H2O?Al(OH)3+3H+的平衡常数为 .
(3)写出加入30%H2O2过程中发生的离子反应方程式: .
(4)加入Pb(NO3)2沉淀CrO42-时,检验沉淀是否完全的方法是 .
(5)在废液中加入10%明矾溶液发生反应的化学方程式为 .

(1)将铬污泥粉碎的目的是
(2)废渣的主要成分是Al(OH)3和Fe(OH)3.已知25℃时,Al(OH)3的Ksp=1.3×10-33,则该温度下反应Al3++3H2O?Al(OH)3+3H+的平衡常数为
(3)写出加入30%H2O2过程中发生的离子反应方程式:
(4)加入Pb(NO3)2沉淀CrO42-时,检验沉淀是否完全的方法是
(5)在废液中加入10%明矾溶液发生反应的化学方程式为
考点:物质分离和提纯的方法和基本操作综合应用,制备实验方案的设计
专题:实验设计题
分析:流程分析可知,铬污泥(主要成分为Cr2O3,杂质为Fe2O3、Al2O3、SiO2)为原料粉碎后在反应器中加入浓盐酸浸取,因二氧化硅不反应,经过滤可得到废渣为二氧化硅,溶液a中含有Fe3+、Al3+、Cr3+等,加入碳酸钠溶液调节pH8.5~9.5,可除去Fe3+、Al3+,得到的废渣为Al(OH)3和Fe(OH)3,在CrO22-溶液中加入过氧化氢,经氧化可得到CrO42-溶液,然后加入Pb(NO3)2溶液,可得到PbCrO4沉淀,过滤后废液中含有Pb(NO3)2,加入明矾可得到硫酸铅.
(1)将铬污泥粉碎可以增大与盐酸的接触面积,有利于提高浸取率;
(2)Ksp[Al(OH)3]=c(Al3+)?c3(OH-),水解平衡常数Kh=
,故Ksp[Al(OH)3]?Kh=(kw)3,据此计算;
(3)由流程图可知,加入30%H2O2的目的是在碱性条件下将CrO2-氧化为CrO42-,同时生成水;
(4)检验沉淀是否完全的方法是:静置分层后,取上层清液,继续滴加Pb(NO3)2溶液,无沉淀生成,说明沉淀完全;
(5)由流程图可知,由加入的Pb(NO3)2溶液是过量的,故废液中含有Pb(NO3)2,废液中加入10%明矾溶液目的是将Pb2+转化为PbSO4沉淀.
(1)将铬污泥粉碎可以增大与盐酸的接触面积,有利于提高浸取率;
(2)Ksp[Al(OH)3]=c(Al3+)?c3(OH-),水解平衡常数Kh=
| c3(H+) |
| c(Al3+) |
(3)由流程图可知,加入30%H2O2的目的是在碱性条件下将CrO2-氧化为CrO42-,同时生成水;
(4)检验沉淀是否完全的方法是:静置分层后,取上层清液,继续滴加Pb(NO3)2溶液,无沉淀生成,说明沉淀完全;
(5)由流程图可知,由加入的Pb(NO3)2溶液是过量的,故废液中含有Pb(NO3)2,废液中加入10%明矾溶液目的是将Pb2+转化为PbSO4沉淀.
解答:
解:流程分析可知,铬污泥(主要成分为Cr2O3,杂质为Fe2O3、Al2O3、SiO2)为原料粉碎后在反应器中加入浓盐酸浸取,因二氧化硅不反应,经过滤可得到废渣为二氧化硅,溶液a中含有Fe3+、Al3+、Cr3+等,加入碳酸钠溶液调节pH8.5~9.5,可除去Fe3+、Al3+,得到的废渣为Al(OH)3和Fe(OH)3,在CrO22-溶液中加入过氧化氢,经氧化可得到CrO42-溶液,然后加入Pb(NO3)2溶液,可得到PbCrO4沉淀,过滤后废液中含有Pb(NO3)2,加入明矾可得到硫酸铅,
(1)将铬污泥粉碎可以增大与盐酸的接触面积,有利于提高浸取率;
故答案为:增大接触面积,提高浸取率;
(2)Ksp[Al(OH)3]=c(Al3+)?c3(OH-)=1.3×10-33,水解平衡常数Kh=
,故Ksp[Al(OH)3]?Kh=(kw)3=(10-14)3=10-42,所以Kh=
=7.7×10-10;
故答案为:7.7×10-10;
(3)由流程图可知,加入30%H2O2的目的是在碱性条件下将CrO2-氧化为CrO42-,同时生成水,反应离子方程式为3H2O2+2CrO2-+2OH-=2CrO42-+4H2O;
故答案为:3H2O2+2CrO2-+2OH-=2CrO42-+4H2O;
(4)检验沉淀是否完全的方法是:静置分层后,取上层清液,继续滴加Pb(NO3)2溶液,无沉淀生成,说明沉淀完全;
故答案为:静置分层后,取上层清液,继续滴加Pb(NO3)2溶液,无沉淀生成,说明沉淀完全;
(5)废液中含有Pb(NO3)2,废液中加入10%明矾溶液目的是将Pb2+转化为PbSO4沉淀,反应方程式为2Pb(NO3)2+KAl(SO4)2=2PbSO4↓+KNO3+Al(NO3)3;
故答案为:2Pb(NO3)2+KAl(SO4)2=2PbSO4↓+KNO3+Al(NO3)3.
(1)将铬污泥粉碎可以增大与盐酸的接触面积,有利于提高浸取率;
故答案为:增大接触面积,提高浸取率;
(2)Ksp[Al(OH)3]=c(Al3+)?c3(OH-)=1.3×10-33,水解平衡常数Kh=
| c3(H+) |
| c(Al3+) |
| 10-42 |
| 1.3×10-33 |
故答案为:7.7×10-10;
(3)由流程图可知,加入30%H2O2的目的是在碱性条件下将CrO2-氧化为CrO42-,同时生成水,反应离子方程式为3H2O2+2CrO2-+2OH-=2CrO42-+4H2O;
故答案为:3H2O2+2CrO2-+2OH-=2CrO42-+4H2O;
(4)检验沉淀是否完全的方法是:静置分层后,取上层清液,继续滴加Pb(NO3)2溶液,无沉淀生成,说明沉淀完全;
故答案为:静置分层后,取上层清液,继续滴加Pb(NO3)2溶液,无沉淀生成,说明沉淀完全;
(5)废液中含有Pb(NO3)2,废液中加入10%明矾溶液目的是将Pb2+转化为PbSO4沉淀,反应方程式为2Pb(NO3)2+KAl(SO4)2=2PbSO4↓+KNO3+Al(NO3)3;
故答案为:2Pb(NO3)2+KAl(SO4)2=2PbSO4↓+KNO3+Al(NO3)3.
点评:本题考查物质的分离、提纯的综合应用,为高考常见题型,侧重于学生的分析能力和实验能力的考查,本题注重平衡常数的计算、离子的检验、氧化还原反应等知识点,难度不大,离子的检验是高考的热点,注意(4)题中化学语言的正确运用,为易错点.

练习册系列答案
相关题目
向盛有100g水的A、B、C、D四个烧杯中分别加入等物质的量的Na、Na2O、Na2O2、NaOH固体,固体全部溶解得澄清溶液,则各烧杯溶液中溶质的质量分数的顺序为( )
| A、D>C>B>A |
| B、B>C>A>D |
| C、B=C>A>D |
| D、B=C>D>A |