题目内容
某同学欲配制80mL物质的量浓度为0.5mol?L-1的CuSO4溶液.
(1)完成该实验用到的仪器主要有: 、托盘天平、胶头滴管、量筒、烧杯、玻璃棒.
(2)如果用CuSO4?5H2O来配制,应该称量固体的质量为 .
(3)写出简单操作过程:计算→称量→溶解→冷却→ →洗涤→定容→摇匀→贴标签.
(4)定容时的正确操作是:待容量瓶中液体的液面距离容量瓶的刻度线1~2cm时,改用胶头滴管滴加,并且目光要平视刻度线,至 ,定容完成.
(5)下列操作对溶液的浓度有何影响?(填“偏大”“偏小”或“没影响”)?
①使用前容量瓶用蒸馏水洗涤,且没有干燥.( )
②定容时,不小心加水过量,马上再用胶头滴管吸出.( )
③定容时俯视液面.( )
(1)完成该实验用到的仪器主要有:
(2)如果用CuSO4?5H2O来配制,应该称量固体的质量为
(3)写出简单操作过程:计算→称量→溶解→冷却→
(4)定容时的正确操作是:待容量瓶中液体的液面距离容量瓶的刻度线1~2cm时,改用胶头滴管滴加,并且目光要平视刻度线,至
(5)下列操作对溶液的浓度有何影响?(填“偏大”“偏小”或“没影响”)?
①使用前容量瓶用蒸馏水洗涤,且没有干燥.(
②定容时,不小心加水过量,马上再用胶头滴管吸出.(
③定容时俯视液面.(
考点:配制一定物质的量浓度的溶液
专题:
分析:(1)配制80mL溶液,需要选用100mL容量瓶,实际上配制的是100mL 0.5mol/L的硫酸铜溶液,根据配制步骤是计算、称量、溶解、移液、洗涤、定容、摇匀、装瓶来分析需要的仪器;
(2)根据n=cV计算出硫酸铜的物质的量,再根据m=nM分别计算出需要的五水硫酸铜的质量;
(3)根据配制步骤是计算、称量、溶解、移液、洗涤、定容、摇匀、装瓶来分析操作过程;
(4)根据定容的操作来分析;
(5)根据c=
并结合溶质的物质的量n和溶液的体积V的变化来进行误差分析;
(2)根据n=cV计算出硫酸铜的物质的量,再根据m=nM分别计算出需要的五水硫酸铜的质量;
(3)根据配制步骤是计算、称量、溶解、移液、洗涤、定容、摇匀、装瓶来分析操作过程;
(4)根据定容的操作来分析;
(5)根据c=
| n |
| V |
解答:
解:(1)配制80mL溶液,需要选用100mL容量瓶,实际上配制的是100mL 0.5mol/L的硫酸铜溶液,根据操作步骤有计算、称量、溶解、移液、洗涤、定容、摇匀等操作,一般用托盘天平称量,用药匙取用药品,在烧杯中溶解(可用量筒量取水加入烧杯),并用玻璃棒搅拌,加速溶解.冷却后转移到100mL容量瓶中,并用玻璃棒引流,洗涤烧杯、玻璃棒2-3次,并将洗涤液移入容量瓶中,加水至液面距离刻度线1~2cm时,改用胶头滴管滴加,最后定容颠倒摇匀.所以所需仪器有托盘天平、量筒、烧杯、玻璃棒、100mL容量瓶、胶头滴管,故答案为:100mL容量瓶;
(2)配制100mL 0.5mol/L的硫酸铜溶液,需要硫酸铜的物质的量为:n(CuSO4)=0.5mol/L×0.1L=0.05mol,需要五水硫酸铜的物质的量为0.05mol,故需要五水硫酸铜的质量为:m(CuSO4?5H2O)=250g/mol×0.05mol=12.5g,
故答案为:12.5g;
(3)根据配制步骤是计算、称量、溶解、冷却、移液、洗涤、定容、摇匀、装瓶可知,答案为:移液;
(4)定容时的正确操作是:待容量瓶中液体的液面距离容量瓶的刻度线1~2cm时,改用胶头滴管滴加,并且目光要平视刻度线,至凹液面最低处与刻度线相切即可.故答案为:凹液面最低处与刻度线相切;
(5)①若容量瓶未干燥即用来配制溶液,对溶液浓度无影响,因为只要定容时正确,至于水是原来就有的还是后来加入的,对浓度无影响,故答案为:没影响;
②定容时,不小心加水过量,马上再用胶头滴管吸出,则吸出的不止是水也有溶质,会导致溶液浓度偏小,故答案为:偏小;
③定容时俯视液面,则溶液体积偏小,则浓度偏大,故答案为:偏大.
(2)配制100mL 0.5mol/L的硫酸铜溶液,需要硫酸铜的物质的量为:n(CuSO4)=0.5mol/L×0.1L=0.05mol,需要五水硫酸铜的物质的量为0.05mol,故需要五水硫酸铜的质量为:m(CuSO4?5H2O)=250g/mol×0.05mol=12.5g,
故答案为:12.5g;
(3)根据配制步骤是计算、称量、溶解、冷却、移液、洗涤、定容、摇匀、装瓶可知,答案为:移液;
(4)定容时的正确操作是:待容量瓶中液体的液面距离容量瓶的刻度线1~2cm时,改用胶头滴管滴加,并且目光要平视刻度线,至凹液面最低处与刻度线相切即可.故答案为:凹液面最低处与刻度线相切;
(5)①若容量瓶未干燥即用来配制溶液,对溶液浓度无影响,因为只要定容时正确,至于水是原来就有的还是后来加入的,对浓度无影响,故答案为:没影响;
②定容时,不小心加水过量,马上再用胶头滴管吸出,则吸出的不止是水也有溶质,会导致溶液浓度偏小,故答案为:偏小;
③定容时俯视液面,则溶液体积偏小,则浓度偏大,故答案为:偏大.
点评:本题考查了一定物质的量浓度溶液的配制过程中的计算和误差分析,属于基础型题目,难度不大.

练习册系列答案
 小学同步三练核心密卷系列答案
小学同步三练核心密卷系列答案
相关题目
向盛有100g水的A、B、C、D四个烧杯中分别加入等物质的量的Na、Na2O、Na2O2、NaOH固体,固体全部溶解得澄清溶液,则各烧杯溶液中溶质的质量分数的顺序为( )
| A、D>C>B>A |
| B、B>C>A>D |
| C、B=C>A>D |
| D、B=C>D>A |
下列实验装置或操作与粒子的大小有直接关系的是( )
A、 蒸馏 |
B、 蒸发 |
C、 萃取 |
D、 丁达尔效应 |
已知,粗盐中除了含有少量的泥沙外,还含有可溶性的CaCl2、MgCl2、Na2SO4 等杂质,先将粗盐溶于水后,再通过如下几个实验步骤,可制得纯净的食盐水:①加入稍过量的Na2CO3溶液;②加入稍过量的NaOH溶液; ③加入稍过量的BaCl2溶液;④滴入稀盐酸至溶液呈中性;⑤过滤.正确的操作顺序是( )
| A、②①③⑤④ |
| B、⑤③②①⑤④ |
| C、⑤②③①④⑤ |
| D、③⑤②①④ |
尿素是一种重要的氮肥,其合成反应为:2NH3(l)+CO2(g)?CO(NH2)2(l)+H2O(l)△H=-103.7kJ?mol-1影响尿素合成反应平衡的主要因素有温度、压力、氨碳比[n(NH3)/n(CO2)]、水碳比[n(H2O)/n(CO2)]等因素,下列说法正确的是( )
| A、升高温度能加快生成尿素的速率 |
| B、增大压强能使反应有利于向生物方向移动 |
| C、氨碳比越大越有利于尿素的生成 |
| D、若氨能与反应生成的水结合生成一水合氨,则能促使平衡向生成尿素方向移动 |
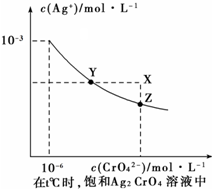 已知:t℃时,Ag2CrO4(红色固体)在水中的沉淀溶解平衡曲线如图所示; t℃时AgCl的Ksp=2×10-10.下列说法正确的是( )
已知:t℃时,Ag2CrO4(红色固体)在水中的沉淀溶解平衡曲线如图所示; t℃时AgCl的Ksp=2×10-10.下列说法正确的是( )| A、t℃时,Y点对应的Ksp(Ag2CrO4)为1×10-9 |
| B、t℃时,Ag2CrO4的溶解度(mol/L)小于AgCl |
| C、t℃时,若使溶液由Z点到X点,可采取在饱和Ag2CrO4溶液中加入适量AgNO3固体的办法实现 |
| D、t℃时,利用沉淀滴定法,用标准AgNO3溶液滴定KCl溶液的浓度时,可滴入几滴K2CrO4溶液做指示剂 |
