题目内容
2.在浓度均为3mol/L的盐酸和硫酸各100mL溶液中,分别加入等质量的铁粉,充分反应后生成气体质量之比为3:4.则加入铁粉的质量是( )| A. | 1.8 g | B. | 11.2 g | C. | 5.6 g | D. | 8.4 g |
分析 发生反应为:Fe+2HCl═FeCl2+H2↑①、Fe+H2SO4═FeSO4+H2↑②,加入铁粉质量相等,如果对于这两个反应都是铁不足,则Fe完全反应,生成气体体积之比为1:1,若酸都不足,则酸完全反应,根据方程式可知,生成的气体体积之比为1:2,而实际气体体积之比为2:3,所以肯定是铁对一个反应来说是不足,对于另一个反应是过量.通过方程式可以看出来,铁消耗HCl多,对于①反应来说是盐酸不足,可以算出来生成H2物质的量,根据体积比可算出来②反应生成n(H2),对于②反应是Fe不足,以此计算铁的质量.
解答 解:发生反应为:Fe+2HCl═FeCl2+H2↑①、Fe+H2SO4═FeSO4+H2↑②,加入铁粉质量相等,
如果对于这两个反应都是铁不足,则Fe完全反应,生成气体体积之比为1:1,
若酸都不足,则酸完全反应,根据方程式可知,生成的气体体积之比为1:2,
而实际气体体积之比为2:3,所以肯定是铁对一个反应来说是不足,对于另一个反应是过量.通过方程式可以看出来,铁消耗HCl多,对于①反应来说是盐酸不足,对于②反应是Fe不足,
反应①生成气体的物质的量为$\frac{0.1L×3mol/L}{2}$=0.15mol,反应完毕后生成气体的体积之比为3:4,所以Fe与硫酸生成的气体为0.15mol×$\frac{4}{3}$=0.2mol,
设铁的质量为x,则:
Fe+H2SO4═FeSO4+H2↑
56g 1mol
x 0.2mol
所以,56g:x=1mol:0.2mol,解得x=11.2g,
故选B.
点评 本题考查过量计算,题目难度中等,通过反应方程式判断反应的过量问题是关键.

练习册系列答案
相关题目
12.在一定条件下,红棕色的NO2可以发生如下反应:2NO2(g)?2NO(g)+O2(g)△H>0,下列叙述中正确的是( )
| A. | 恒温恒容,充入NO2气体,其转化率增大 | |
| B. | 加压,平衡向逆反应方向移动,混合气体颜色变深 | |
| C. | 若平衡常数增大,则可能是升高了温度或减小了体系的压强 | |
| D. | 当2v正(NO)=v逆(O2)时,反应达到化学平衡状态 |
13.化合物X是一种医药中间体,其结构简式如图所示.下列有关化合物X的说法正确的是( )
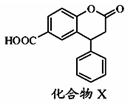

| A. | 分子中两个苯环一定处于同一平面 | |
| B. | 不能与饱和Na2CO3溶液反应 | |
| C. | 在酸性条件下水解,水解产物只有一种 | |
| D. | 1mol化合物X最多能与7molH2反应 |
10.Na2O2是中学化学常用试剂,下列说法错误是( )
| A. | 0.1mol Na2O2与足量CO2反应转移的电子的物质的量为0.1mol | |
| B. | 将Na2O2粉末加入到饱和NaOH溶液中,OH-离子浓度一定不变 | |
| C. | 等物质的量的Na2O2与Na2O溶于等质量水中得到的NaOH的物质的量浓度相同 | |
| D. | 等质量的Na2O2与Na2S晶体中含有相同数目的阴离子 |
17. 某班学生用0.1mol•L-1盐酸和0.1mol•L-1NaOH溶液反应测定酸碱滴定曲线,甲、乙、丙三组同学锥形瓶中的溶液所取体积均为20.00mL,且所用的试剂完全相同,根据实验所得的数据绘制的曲线分别如图中a、b、c所示,下列说法错误的是( )
某班学生用0.1mol•L-1盐酸和0.1mol•L-1NaOH溶液反应测定酸碱滴定曲线,甲、乙、丙三组同学锥形瓶中的溶液所取体积均为20.00mL,且所用的试剂完全相同,根据实验所得的数据绘制的曲线分别如图中a、b、c所示,下列说法错误的是( )
 某班学生用0.1mol•L-1盐酸和0.1mol•L-1NaOH溶液反应测定酸碱滴定曲线,甲、乙、丙三组同学锥形瓶中的溶液所取体积均为20.00mL,且所用的试剂完全相同,根据实验所得的数据绘制的曲线分别如图中a、b、c所示,下列说法错误的是( )
某班学生用0.1mol•L-1盐酸和0.1mol•L-1NaOH溶液反应测定酸碱滴定曲线,甲、乙、丙三组同学锥形瓶中的溶液所取体积均为20.00mL,且所用的试剂完全相同,根据实验所得的数据绘制的曲线分别如图中a、b、c所示,下列说法错误的是( )| A. | 乙组同学操作上的不足是在滴定终点附近测试和记录pH的间隔太大 | |
| B. | 甲组同学滴定时选用的滴定管为酸式滴定管 | |
| C. | 乙和丙两组同学的操作均存在不足或失误 | |
| D. | 丙组同学可能是用待测液润洗了锥形瓶 |
7.下列说法中不正确的是( )
| A. | 人体缺碘,可通过食用加碘盐补碘 | |
| B. | 为了防止龋齿,人人都要使用含氟牙膏 | |
| C. | 缺铁性贫血,可通过食用铁强化酱油预防 | |
| D. | 儿童缺锌可导致生长发育不良,抵抗力差,食欲不振 |
14.某烷烃只能生成一种一氯化物,此烷烃的分子式不可能是( )
| A. | CH4 | B. | C4H10 | C. | C5H12 | D. | C8H18 |
16.甲醇是重要的化工原料,又可做燃料.利用合成气(主要成分为CO、CO2和H2)在催化剂的作用下合成甲醇,主要反应如下:
①CO(g)+2H2(g)?CH3OH(g)△H1
②CO2(g)+3H2(g)?CH3OH(g)+H2O(g)△H2=-58kJ/mol
③CO2(g)+H2(g)?CO(g)+H2O(g)△H3
已知反应①中的相关的化学键键能数据如下:
回答下列问题:
①△H3=+41kJ/mol.
②25℃,101kPa条件下,测得16g甲醇完全燃烧释放出Q kJ的热量,请写出表示甲醇燃烧热的热化学方程式CH3OH(l)+$\frac{3}{2}$O2(g)=CO2+2H2O△H=-2QkJ/mol.
①CO(g)+2H2(g)?CH3OH(g)△H1
②CO2(g)+3H2(g)?CH3OH(g)+H2O(g)△H2=-58kJ/mol
③CO2(g)+H2(g)?CO(g)+H2O(g)△H3
已知反应①中的相关的化学键键能数据如下:
| 化学键 | H-H | C-O | C≡O (CO中的化学键) | H-O | C-H |
| E/(kJ/mol) | 436 | 343 | 1076 | 465 | 413 |
①△H3=+41kJ/mol.
②25℃,101kPa条件下,测得16g甲醇完全燃烧释放出Q kJ的热量,请写出表示甲醇燃烧热的热化学方程式CH3OH(l)+$\frac{3}{2}$O2(g)=CO2+2H2O△H=-2QkJ/mol.
17.含有MgSO4和Al2(SO4)3的混合溶液,已知其中Al3+的物质的量浓度为0.4mol/L,Mg2+的物质的量浓度为0.3mol/L,则此溶液中SO42-的物质的量浓度为( )
| A. | 0.9 mol/L | B. | 1.8 mol/L | C. | 0.7mol/L | D. | 0.5mol/L |