题目内容
17.碱式氧化镍[NiO(OH)]可用作镍氢电池的正极材料.工业上以含镍(Ni2+)废液为原料生产的一种工艺流程如图: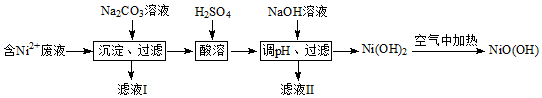
(1)加入Na2CO3溶液时,确认Ni2+已经完全沉淀的实验方法是静置,在上层清液中继续滴加1~2滴Na2CO3溶液,无沉淀生成,若无沉淀生成,说明Ni2+已经完全沉淀.
(2)滤液Ⅱ中所含溶质的化学式为Na2SO4,实验室里进行过滤操作时需要的玻璃仪器有玻璃棒、烧杯、漏斗.
(3)写出在空气中加热Ni(OH)2制取NiO(OH)的化学方程式:4Ni(OH)2+O2$\frac{\underline{\;\;△\;\;}}{\;}$4NiO(OH)+2H2O.
(4)若加热不充分,制得的NiO(OH)样品中会混有Ni(OH)2,为测定加热后所得样品中NiO(OH)的质量分数,进行如下实验:称取2.00g样品溶于稀硫酸,加入100mL 0.25mol/L Fe2+的标准溶液,搅拌至溶液清亮,再定容至100mL后取出20.00mL,用0.010mol/L KMnO4标准溶液滴定,用去KMnO4标准溶液20.00mL.
试通过计算确定NiO(OH)的质量分数(写出计算过程,计算结果精确到0.1%).
测定过程中涉及反应如下:
NiO(OH)+Fe2++3H+═Ni2++Fe3++2H2O
5Fe2++MnO4-+8H+═5Fe3++Mn2++4H2O.
分析 含镍(Ni2+)废液为原料生产NiOOH,在含Ni+的废液中中加入碳酸钠溶液,过滤得到NiCO3沉淀,沉淀中加入硫酸溶解生成NiSO4,加入NaOH溶液使镍离子全部沉淀生成Ni(OH)2,在空气中加热Ni(OH)2制取NiOOH;
(1)确认Ni2+已经完全沉淀的实验方法是取上层清液,加入碳酸钠溶液观察是否有沉淀生成,判断镍离子是否全部沉淀;
(2)NiSO4与NaOH溶液反应生成Ni(OH)2和Na2SO4;过滤操作时需要的玻璃仪器有玻璃棒、烧杯、漏斗;
(3)Ni(OH)2在空气中加热NiO(OH)和水;
(4)消耗KMnO4物质的量:0.01 mol•L-1×0.02L=2×10-4 mol,
与NiOOH反应后剩余的Fe2+物质的量:2×10-4 mol×5×(100÷20)=0.005 mol,
Fe2+总物质的量:0.25 mol•L-1×0.1 L=0.025mol,
与NiOOH反应的Fe2+的物质的量:0.025mol-0.005mol=0.02mol,
得到n(NiOOH)=0.02mol,计算得到NiOOH的质量,得到NiO(OH)的质量分数.
解答 解:(1)确认Ni2+已经完全沉淀的实验方法是取上层清液,加入碳酸钠溶液观察是否有沉淀生成,判断镍离子是否全部沉淀,具体操作步骤为:静置,在上层清液中继续滴加1~2滴Na2CO3溶液,无沉淀生成;
故答案为:静置,在上层清液中继续滴加1~2滴Na2CO3溶液,无沉淀生成,若无沉淀生成,说明Ni2+已经完全沉淀;
(2)根据分析可知,NiSO4与NaOH溶液反应生成Ni(OH)2和Na2SO4,故滤液Ⅱ中所含溶质的化学式为Na2SO4;过滤操作时需要的玻璃仪器有玻璃棒、烧杯、漏斗;
故答案为:Na2SO4;漏斗;
(3)空气中加热Ni(OH)2和空气中氧气反应生成NiOOH和水,原子守恒配平书写化学方程式为:4Ni(OH)2+O2 $\frac{\underline{\;\;△\;\;}}{\;}$4 NiO(OH)+2H2O;
故答案为:4Ni(OH)2+O2 $\frac{\underline{\;\;△\;\;}}{\;}$4 NiO(OH)+2H2O;
(4)消耗KMnO4物质的量:0.01 mol•L-1×0.02L=2×10-4 mol,
与NiOOH反应后剩余的Fe2+物质的量:2×10-4 mol×5×(100÷20)=0.005 mol,
Fe2+总物质的量:0.25 mol•L-1×0.1 L=0.025mol,
与NiOOH反应的Fe2+的物质的量:0.025mol-0.005mol=0.02mol,
得到n(NiOOH)=0.02mol,m(NiOOH)=91.7 g•mol-1×0.02 mol=1.834g,NiO(OH)的质量分数为$\frac{1.834g}{2.0}×100%$=91.7%;
答:NiO(OH)的质量分数为91.7%.
点评 本题考查了物质分离方法和实验过程分析判断等,题目难度中等,明确实验目的及化学实验基本操作方法为解答关键,试题培养了学生的分析能力及化学实验能力.

 阅读快车系列答案
阅读快车系列答案| A. | 切开的金属 Na 暴露在空气中,光亮表面逐渐变暗2Na+O2═Na 2O2 | |
| B. | 向 AgCl 悬浊液中滴加 Na2S 溶液,白色沉淀变成黑色2AgCl+S2-═Ag2S↓+2Cl- | |
| C. | Na 2O2 在潮湿空气中放置一段时间,变成白色黏稠物2Na 2O2+2CO2═2Na 2CO3+O2 | |
| D. | 向 NaHCO3 溶液中加入过量的澄清石灰水,出现白色沉淀2HCO3-+Ca 2++2OH-═CaCO3↓+CO32-+2H2O |

| A. | 该反应是加成反应 | |
| B. | 若R为CH3时,b中所有原子可能共面 | |
| C. | 若R为C4H9时,取代b苯环上的氢的一氯代物的可能的结构共有12种 | |
| D. | 若R为C4H5O时,lmol b最多可以与6mol H2加成 |
| A. | 在银氨溶液中可大量含有:Cu2+、K+、Cl-、SO42- | |
| B. | 使甲基橙试液变红色的溶液中可大量含有:K+,Na+,S2-,SO32- | |
| C. | 室温下,pH=12的碱性溶液中一定没有CH3COOH分子 | |
| D. | 在c(H+)=10-14mol/L的溶液中可大量含有:Na+,AlO2-,CO32-,SO42- |

| A. | 氨可用作制冷剂 | |
| B. | 铵态氮肥一般不能与碱性化肥混合使用 | |
| C. | 硝酸可用于制化肥、农药、炸药、染料、盐类等 | |
| D. | 某浓硝酸中含有溶质2 mol,标准状况下,该浓硝酸与足量的铜完全反应能生成1 mol NO2 |
| A. | 酸性氧化物:CO2、Mn2O7 | B. | 胶体:淀粉溶液、氯化铁溶液 | ||
| C. | 同素异形体:1H2O、D2O | D. | 碱式盐:Cu2(OH)2CO3、NaHCO3 |
 在一定条件下,反应A2+B2?2AB;△H=QkJ/mol的反应时间与生成物AB的质量分数(AB%)的关系如图所示,其中a、b为不同温度时的反应曲线(其他条件不变),c为在t3时刻开始缩小容器容积(温度不变)的变化曲线.下列有关说法正确的是( )
在一定条件下,反应A2+B2?2AB;△H=QkJ/mol的反应时间与生成物AB的质量分数(AB%)的关系如图所示,其中a、b为不同温度时的反应曲线(其他条件不变),c为在t3时刻开始缩小容器容积(温度不变)的变化曲线.下列有关说法正确的是( )| A. | △H>0 | B. | AB一定是气体物质 | ||
| C. | 反应温度a低于b | D. | A2、B2中最少有一种是气态物质 |