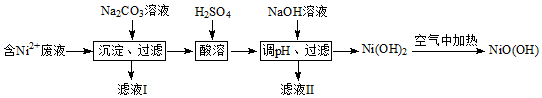
题目内容
4.工业上通过氮气和氢气反应合成氨,氨经一系列反应可以得到硝酸.反应历程如图所示:下列说法不正确的是( )
| A. | 氨可用作制冷剂 | |
| B. | 铵态氮肥一般不能与碱性化肥混合使用 | |
| C. | 硝酸可用于制化肥、农药、炸药、染料、盐类等 | |
| D. | 某浓硝酸中含有溶质2 mol,标准状况下,该浓硝酸与足量的铜完全反应能生成1 mol NO2 |
分析 A.氨液化后挥发带走能量,所以可用作制冷剂;
B.铵态氮肥溶解后铵根离子水解显酸性;
C.依据硝酸的性质和应用分析;
D.某浓硝酸中含有溶质2mol,标准状况下,该浓硝酸与足量的铜完全反,随反应进行硝酸变稀后生成一氧化氮;
解答 解;A.液氨挥发过程中吸收能量,可用作制冷剂,故A正确;
B.铵态氮肥溶解后铵根离子水解显酸性,一般不能与碱性化肥共同使用,故B正确;
C.硝酸可用于制化肥、农药、炸药、染料、盐类等,故C正确;
D.某浓硝酸中含有溶质2mol,标准状况下,该浓硝酸与足量的铜完全反应,随反应进行溶液浓度变稀后反应生成一氧化氮气体,生成NO2 小于1mol,故D错误;
故选:D.
点评 本题考查了氮及其化合物性质的分析应用,是一道元素及化合物性质的综合题,难度中等,要求学生具备分析和解决问题的能力.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
12.已知X、Y是主族元素,I为电离能,单位是kJ/mol.请根据下表所列数据判断,错误的( )
| 元素 | I1 | I2 | I3 | I4 |
| X | 500 | 4600 | 6900 | 9500 |
| Y | 580 | 1800 | 2700 | 11600 |
| A. | 若元素Y处于第三周期,它可与冷水剧烈反应 | |
| B. | 元素Y是ⅢA族元素 | |
| C. | 元素X与氧形成化合物时,化学式可能是X2O或X2O2 | |
| D. | 元素X的常化合价是+1 |
13.下列关于有机化合物的说法正确的是( )
| A. | 分子式为C7H8O含有苯环且属于醇类的同分异构体有4种 | |
| B. | 乙炔能使溴的四氯化碳溶液褪色是发生了氧化反应 | |
| C. | 苯分子中所有原子都在同一平面上 | |
| D. | 乙酸乙酯少量乙酸杂质可加饱和NaOH溶液后经分液除去 |
10.下列实验操作或装置正确的是( )
| A. |  利用图所示操作制备氢氧化铁胶体 | |
| B. |  利用图所示装置制取NH3 | |
| C. |  制备Fe(OH)2:用图所示装置,向试管中加入NaOH溶液,振荡 | |
| D. |  用图装置测定中和热 |
9.根据原子结构及元素周期律的知识,下列推断正确的是( )
| A. | 第IIA族元素的金属性比第IIIA族元素的强 | |
| B. | 核外电子排布相同的微粒化学性质也相同 | |
| C. | O2-、F-、Na+、Mg2+半径逐渐减小 | |
| D. | 16O与18O得电子能力前者强 |
16.阿伏加德罗常数约为6.02×1023mol-1.下列叙述中正确的是( )
| A. | 32 g含有少量臭氧的氧气中,共含有氧原子数为2×6.02×1023 | |
| B. | 标准状况下,11.2 L四氯化碳含有的分子数为0.5×602×1023 | |
| C. | 5.6 g铁粉完全溶于硝酸,失去的电子数一定为0.3×6.02×1023 | |
| D. | 1 L0.5 mol/L Na2CO3 溶液中含有的CO32-数目为0.5×6.02×1023 |
13.NA表示阿伏加德罗常数的值,下列说法正确的是( )
| A. | 标准状况下,11.2LCCl4含有的分子数目为0.5NA | |
| B. | 将10mL 1 mol/L FeCl3溶浪滴入沸水中,所得氢氧化铁胶粒数为0.01NA | |
| C. | 1 mol/LNa2O2固体中含离子总数为3NA | |
| D. | 0.1moIH2O和D2O组成的混合物中含有中子数是NA |
 氨在国民经济中占有重要地位.
氨在国民经济中占有重要地位.