题目内容
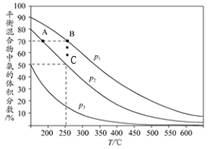
9. 在一定条件下,反应A2+B2?2AB;△H=QkJ/mol的反应时间与生成物AB的质量分数(AB%)的关系如图所示,其中a、b为不同温度时的反应曲线(其他条件不变),c为在t3时刻开始缩小容器容积(温度不变)的变化曲线.下列有关说法正确的是( )
在一定条件下,反应A2+B2?2AB;△H=QkJ/mol的反应时间与生成物AB的质量分数(AB%)的关系如图所示,其中a、b为不同温度时的反应曲线(其他条件不变),c为在t3时刻开始缩小容器容积(温度不变)的变化曲线.下列有关说法正确的是( )| A. | △H>0 | B. | AB一定是气体物质 | ||
| C. | 反应温度a低于b | D. | A2、B2中最少有一种是气态物质 |
分析 “先拐先平”,故a曲线表示的温度大于b;升高温度,AB的含量减小,说明正反应是放热反应;缩小体积,则容器内压强增大,AB的含量减小,说明平衡向逆反应方向移动,即向气体体积减小的方向移动,据此分析解答.
解答 解:升高温度,AB的含量减小,说明正反应是放热反应,所以Q<0;
“先拐先平”,故a曲线表示的温度大于b;
缩小体积,则容器内压强增大,AB的含量减小,说明平衡向逆反应方向移动,即向气体体积减小的方向移动,则AB为气体、A2与B2中有一种是气体,
故选B.
点评 本题考查了图象分析,根据温度、压强变化对AB含量的影响确定该反应的反应热、反应前后气体体积变化,题目难度不大.

练习册系列答案
相关题目
1.下列说法中正确的是( )
| A. | 任何化学反应都能设计成原电池 | |
| B. | 手机上用的锂离子电池属于一次电池 | |
| C. | 原电池中的阳离子向负极移动 | |
| D. | 把锌粒放入盛有盐酸的试管中,加入几滴氯化铜溶液,气泡放出速率加快 |
18.NA代表阿伏加德罗常数的值,下列叙述正确的是( )
| A. | 高温下,5.6gFe与足量水蒸气反应,转移的电子数为0.3NA | |
| B. | 60g乙酸与足量乙醇发生酯化反应,充分反应后断裂的C-O键数目为NA | |
| C. | 100g质量分数为17%的H2O2的水溶液中,极性共价键的数目为NA | |
| D. | 室温下向1L pH=1的醋酸溶液中加水稀释,所得溶液中的H+数目大于0.1NA |
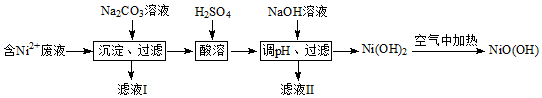

 实验室用如图所示仪器和药品做CO2和Na2O2反应制O2的实验,试填写下列空白.
实验室用如图所示仪器和药品做CO2和Na2O2反应制O2的实验,试填写下列空白.
 氨在国民经济中占有重要地位.
氨在国民经济中占有重要地位.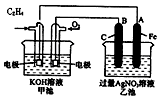 如图是一个化学过程的示意图,请根据该示意图完成下列题目:
如图是一个化学过程的示意图,请根据该示意图完成下列题目: