题目内容
12.对下列各种溶液中所含微粒的判断合理的是( )| A. | 在银氨溶液中可大量含有:Cu2+、K+、Cl-、SO42- | |
| B. | 使甲基橙试液变红色的溶液中可大量含有:K+,Na+,S2-,SO32- | |
| C. | 室温下,pH=12的碱性溶液中一定没有CH3COOH分子 | |
| D. | 在c(H+)=10-14mol/L的溶液中可大量含有:Na+,AlO2-,CO32-,SO42- |
分析 A.铜离子与银氨溶液发生反应;
B.该溶液呈酸性,溶液中存在大量氢离子,硫离子、亚硫酸根离子都与氢离子反应;
C.醋酸钠溶液呈碱性,该溶液中存在醋酸分子;
D.该溶液呈碱性,四种离子之间不反应,都不与氢氧根离子反应.
解答 解:A.Cu2+与银氨溶液反应,在溶液中不能大量共存,故A错误;
B.使甲基橙试液变红色的溶液中存在大量氢离子,S2-,SO32-与氢离子反应,在溶液中不能大量共存,故B错误;
C.CH3COOH为弱电解质,在醋酸根离子溶液中存在水解平衡,则醋酸钠溶液的pH可以为12,该溶液中一定存在CH3COOH分子,故C错误;
D.c(H+)=10-14mol/L的溶液中存在大量氢氧根离子,Na+,AlO2-,CO32-,SO42-之间不反应,都不与氢氧根离子反应,在溶液中能够大量共存,故D正确;
故选D.
点评 本题考查离子共存的正误判断,为高考的高频题,题目难度不大,注意明确离子不能大量共存的一般情况:能发生复分解反应的离子之间;能发生氧化还原反应的离子之间等;还应该注意题目所隐含的条件,如:溶液的酸碱性,据此来判断溶液中是否有大量的 H+或OH-;试题侧重对学生基础知识的训练和检验,有利于培养学生的逻辑推理能力,提高学生灵活运用基础知识解决实际问题的能力.

练习册系列答案
相关题目
3.有四种短周期的主族元素R,E,X,Y,其在周期表中的位置如图所示R,X,Y的原子序数之和为37,下列有关说法正确的是( )
| R | |||
| E | X | Y |
| A. | X的氢化物稳定性比R的氢化物稳定 | |
| B. | E和Y组成的化合物溶于水能促进水的电离 | |
| C. | 0.1mol/L的Y的最高价氧化物对应水化物的pH=1 | |
| D. | E与足量一水合氨反应的离子方程式:2Al+2OH-+2H2O=2AlO2-+3H2 |
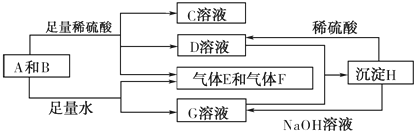
20. A、B、C、D、E为原子序数依次增大的短周期主族元素,分布在三个不同周期.X、Y、Z、W为这些元素形成的化合物,X为二元化合物且为强电解质,W的水溶液呈碱性,物质的转化关系如图所示.下列说法中正确的是( )
A、B、C、D、E为原子序数依次增大的短周期主族元素,分布在三个不同周期.X、Y、Z、W为这些元素形成的化合物,X为二元化合物且为强电解质,W的水溶液呈碱性,物质的转化关系如图所示.下列说法中正确的是( )
 A、B、C、D、E为原子序数依次增大的短周期主族元素,分布在三个不同周期.X、Y、Z、W为这些元素形成的化合物,X为二元化合物且为强电解质,W的水溶液呈碱性,物质的转化关系如图所示.下列说法中正确的是( )
A、B、C、D、E为原子序数依次增大的短周期主族元素,分布在三个不同周期.X、Y、Z、W为这些元素形成的化合物,X为二元化合物且为强电解质,W的水溶液呈碱性,物质的转化关系如图所示.下列说法中正确的是( )| A. | 由A、B、E三种元素共同形成的化合物都含有共价键,水溶液都呈酸性 | |
| B. | C、D分别形成的简单离子的氧化性:C>D | |
| C. | 电解C、E形成的化合物水溶液可生成C、E对应的单质 | |
| D. | C元素所在周期中离子半径最小的是E元素形成的离子 |
7.化学与生产、生活、环境、社会密切相关,下列有关说法中不正确的是( )
| A. | 大力推广农作物的生物防治技术,以减少农药的使用 | |
| B. | 使用加酶洗衣粉,水温越高,洗涤效果更好 | |
| C. | 用CO2合成聚碳酸酯可降解塑料,可以实现“碳”的循环利用 | |
| D. | 国务院要求坚决控制钢铁、水泥、焦炭等高耗能行业产能总量,是落实“低碳经济”的具体举措 |
3.下列叙述正确的是( )
| A. | 1 mol氢氧根离子与1 mol羟基所含电子数均为l0NA | |
| B. | 因为电负性O>N,所以H-O的键能比N-H的键能大,所以水的沸点高于氨气 | |
| C. | 标准状况下,22.4 L NH3分子含有的杂化轨道数为4NA | |
| D. | 1 mol SiO2晶体中含有Si-O键数目为2NA |
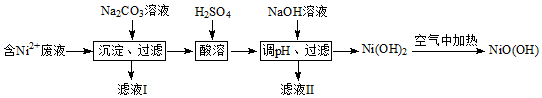
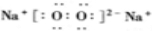 .
.