题目内容
8.相等质量的CO和CH4相比较,请完成下列问题:它们所含的分子数目之比为4:7;同温同压时密度之比为7:4;
同温同体积时的压强之比为4:7.
分析 根据n=$\frac{m}{M}$可知,相等质量的CO和CH4的物质的量之比为16g/mol:28g/mol=4:7.
分子数目之比等于物质的量之比;同温同压下,气体的密度之比等于其摩尔质量之比;同温同体积时,气体的压强之比等于其物质的量之比;
解答 解:根据n=$\frac{m}{M}$可知,相等质量的CO和CH4的物质的量之比为16g/mol:28g/mol=4:7.
分子数目之比等于物质的量之比,相等质量的CO和CH4的所含的分子数目之比为4:7;同温同压下,气体的密度之比等于其摩尔质量之比,CO和CH4的密度之比为28g/mol:16g/mol=7:4;同温同体积时,气体的压强之比等于其物质的量之比,二者压强之比为4:7,
故答案为:4:7; 7:4;4:7.
点评 本题考查阿伏伽德罗定律及其推论,难度不大,注意对基础知识的理解掌握.

练习册系列答案
 全优冲刺100分系列答案
全优冲刺100分系列答案 英才点津系列答案
英才点津系列答案
相关题目
16.某原电池反应的离子方程式为:Zn+2H+═Zn2++H2↑,则下列说法正确的是( )
| A. | HNO3为电解质溶液 | B. | 锌为原电池正极 | ||
| C. | 锌极质量不变 | D. | 铜为原电池正极 |
16.阿伏加德罗常数约为6.02×1023mol-1.下列叙述中正确的是( )
| A. | 32 g含有少量臭氧的氧气中,共含有氧原子数为2×6.02×1023 | |
| B. | 标准状况下,11.2 L四氯化碳含有的分子数为0.5×602×1023 | |
| C. | 5.6 g铁粉完全溶于硝酸,失去的电子数一定为0.3×6.02×1023 | |
| D. | 1 L0.5 mol/L Na2CO3 溶液中含有的CO32-数目为0.5×6.02×1023 |
3.下列叙述正确的是( )
| A. | 1 mol氢氧根离子与1 mol羟基所含电子数均为l0NA | |
| B. | 因为电负性O>N,所以H-O的键能比N-H的键能大,所以水的沸点高于氨气 | |
| C. | 标准状况下,22.4 L NH3分子含有的杂化轨道数为4NA | |
| D. | 1 mol SiO2晶体中含有Si-O键数目为2NA |
13.NA表示阿伏加德罗常数的值,下列说法正确的是( )
| A. | 标准状况下,11.2LCCl4含有的分子数目为0.5NA | |
| B. | 将10mL 1 mol/L FeCl3溶浪滴入沸水中,所得氢氧化铁胶粒数为0.01NA | |
| C. | 1 mol/LNa2O2固体中含离子总数为3NA | |
| D. | 0.1moIH2O和D2O组成的混合物中含有中子数是NA |
18.NA代表阿伏加德罗常数的值,下列叙述正确的是( )
| A. | 高温下,5.6gFe与足量水蒸气反应,转移的电子数为0.3NA | |
| B. | 60g乙酸与足量乙醇发生酯化反应,充分反应后断裂的C-O键数目为NA | |
| C. | 100g质量分数为17%的H2O2的水溶液中,极性共价键的数目为NA | |
| D. | 室温下向1L pH=1的醋酸溶液中加水稀释,所得溶液中的H+数目大于0.1NA |

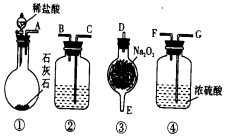 实验室用如图所示仪器和药品做CO2和Na2O2反应制O2的实验,试填写下列空白.
实验室用如图所示仪器和药品做CO2和Na2O2反应制O2的实验,试填写下列空白.