题目内容
14.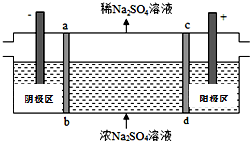 三室式电渗析法处理含Na2SO4废水的原理如图所示,采用惰性电极,ab、cd均为离子交换膜,在直流电场的作用下,两膜中间的Na+和SO42-可通过离子交换膜,而两端隔室中离子被阻挡不能进入中间隔室.下列叙述正确的是( )
三室式电渗析法处理含Na2SO4废水的原理如图所示,采用惰性电极,ab、cd均为离子交换膜,在直流电场的作用下,两膜中间的Na+和SO42-可通过离子交换膜,而两端隔室中离子被阻挡不能进入中间隔室.下列叙述正确的是( )| A. | 通电后中间隔室的SO42-离子向正极迁移,正极区溶液碱性增强 | |
| B. | 该法在处理含Na2SO4废水时可以得到NaOH和H2SO4产品 | |
| C. | 阴极区溶液pH降低,阳极区溶液pH升高 | |
| D. | 当电路中通过1mol电子的电量时,会有0.5mol的O2生成 |
分析 A.阴离子向阳极(即正极区)移动,氢氧根离子放电pH减小;
B.从两极的电极反应和溶液的电中性角度考虑;
C.阴极发生还原反应,氢离子放电,消耗氢离子,阳极发生氧化反应,是水电离的氢氧根放电,生成氢离子;
D.当电路中通过1mol电子的电量时,会有0.25mol的O2生成.
解答 解:A.阴离子向阳极(即正极区)移动,氢氧根离子放电pH减小,故A错误;
B.直流电场的作用下,两膜中间的Na+和SO42-可通过离子交换膜,而两端隔室中离子被阻挡不能进入中间隔室,通电时,氢氧根离子在阳极区放电生成水和氧气,考虑电荷守恒,两膜中间的硫酸根离子会进入正极区,与氢离子结合成硫酸;氢离子在阴极得电子生成氢气,考虑电荷守恒,两膜中间的钠离子会进入负极区,与氢氧根离子结合成氢氧化钠,故可以得到NaOH和H2SO4产品,故B正确;
C.阴极发生还原反应,氢离子得电子生成氢气,氢离子被消耗,PH值增大,阳极发生氧化反应,电极反应式为:2H2O-4e-═O2+4H+,生成氢离子,溶液pH降低,故C错误;
D.每生成1mol氧气转移4mol电子,当电路中通过1mol电子的电量时,会有0.25mol的O2生成,故D错误;
故选B.
点评 本题考查了电解原理的应用,明确电解池中的阴阳极以及阴阳极上离子的放电顺序是解题的关键,注意题干信息的分析应用,题目难度不大.

练习册系列答案
相关题目
2.某酸碱指示剂(HIn)在水溶液中存在以下平衡:
HIn(aq)?H++In-(aq)
(红色) (蓝色)
下列物质的溶液中,能使指示剂显蓝色的是( )
HIn(aq)?H++In-(aq)
(红色) (蓝色)
下列物质的溶液中,能使指示剂显蓝色的是( )
| A. | 稀硫酸 | B. | 氯化铝溶液 | C. | 稀氨水 | D. | 饱和食盐水 |
19.根据下列实验操作和现象所得到的结论正确的是( )
| 选项 | 实验操作和现象 | 结论 |
| A | 将稀硫酸和Na2S反应生成的气体通入AgNO3与AgCl组成的浊液中 | Ksp(AgCl)>Ksp(Ag2S) |
| B | 室温下,向浓度均为0.1 mol•L-1的BaCl2和CaCl2混合溶液中滴加Na2SO4溶液,出现白色沉淀. | Ksp(BaSO4)<Ksp(CaSO4) |
| C | 室温下,向FeCl3溶液中滴加少量KI溶液,再滴加几滴淀粉溶液,溶液变蓝色. | Fe3+的氧化性比I2的强 |
| D | 室温下,用pH试纸测得0.1mol•L-1 Na2SO3溶液的pH约为10;0.1mol•L-1 NaHSO3溶液的pH约为5. | HSO3-结合H+的能力比SO32-的强 |
| A. | A | B. | B | C. | C | D. | D |
3.据《天工开物》记载,我国古代以炉甘石(主要成分是ZnCO3)来升炼倭铅(即锌),其原理如图2.已知锌的熔点420℃、沸点906℃.则下列说法错误的是( )
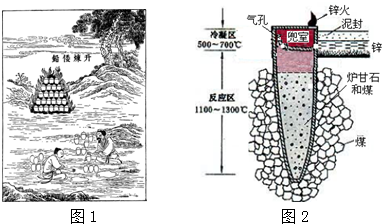

| A. | “泥封”的目的是为了防止得到的锌被氧化 | |
| B. | “锌火”是锌蒸气和一氧化碳在空气的燃烧 | |
| C. | 冶炼时锌变为蒸气在兜室冷凝为固体 | |
| D. | 升炼倭铅过程包含分解反应和氧化还原反应 |
4.下列事实能说明相应的酸是弱电解质的是( )
| A. | 用HR做导电实验,灯泡很暗 | |
| B. | 0.1mol•L-1HR溶液稀释到100倍时,溶液的pH值为3 | |
| C. | 20mL0.1mol•L-1HR恰好中和20mL0.1mol•L-1NaOH溶液 | |
| D. | 0.1mol•L-1NH4R溶液的pH等于7 |
 W、X、Y、Z 是四种常见的短周期元素,其原子半径随原子序数变化如图所示.已知W的一种核素的质量数为18,中子数为10,X和Ne的核外电子数相差1;Y的单质是一种常见的半导体材料;Z的吸引电子的能力在同周期主族元素中最大.
W、X、Y、Z 是四种常见的短周期元素,其原子半径随原子序数变化如图所示.已知W的一种核素的质量数为18,中子数为10,X和Ne的核外电子数相差1;Y的单质是一种常见的半导体材料;Z的吸引电子的能力在同周期主族元素中最大.