题目内容
15.下列分子中,键能最小的是( )| A. | F2 | B. | Br2 | C. | Cl2 | D. | N2 |
分析 根据键长参考两核间的距离大小,两核间的距离大小近似为两个原子的原子半径之和,所以原子半径越大,两核间距离就越大,键长越长,键能越小,电子层数少的原子对其它原子吸引能力小.
解答 解:F、Cl、Br属于第ⅥIA族,且原子序数逐渐增大,所以原子半径大小:Br>Cl>F,F与N属于同一周期,且F的序数大于N,所以原子半径大小:Br>Cl>N>F,所以Br两核间距离最大,Br-Br键长最长,但氟原子比溴原子少两层电子层,原子核对其它原子的吸引能力减弱,所以键能最小的是F2,
故选A.
点评 本题主要考查了键能大小比较,掌握两核间距离的概念以及原子大小的比较方法是解题的关键,题目较简单.

练习册系列答案
相关题目
10.常温下向10mL 0.1mol•L-1的HR溶液中逐滴滴入0.1mol•L-1的NH3•H2O溶液,所得溶液pH及导电性变化如下图.下列分析不正确的是( )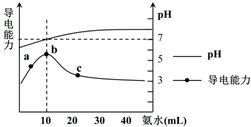

| A. | a~b点导电能力增强说明HR为弱酸 | |
| B. | b点溶液pH=7说明NH4R没有水解 | |
| C. | c 点溶液存在c(NH4+)>c(R-)、c(OH-)>c(H+) | |
| D. | b-c任意点溶液均有c(H+)•c(OH-)=Kw=1.0×10-14 mol2•L-2 |
7.下列物质中,只含有共价键的是( )
| A. | H2O | B. | Na2CO3 | C. | Na2O2 | D. | KOH |
4.下表中物质甲物质一定条件下与乙组中的4种物质都能发生反应的是( )
| 选项 | 甲物质 | 乙组中的物质 |
| A | SO2 | KI3溶液、氨水、KMnO4溶液、苯酚钠溶液 |
| B | Mg | Cl2、CO2、NH4Cl溶液、NaOH溶液 |
| C | SiO2 | HF溶液、NaOH溶液、稀硝酸、Na2CO3 |
| D | 稀硫酸 | Al(OH)3、碳、Cu2(OH)2CO3、Cu |
| A. | A | B. | B | C. | C | D. | D |
5.钢铁在潮湿的空气中会被腐蚀,发生的原电池反应为:2Fe+2H2O+O2═2Fe(OH)2.以下说法正确的是( )
| A. | 负极发生的反应为:Fe-2e-═Fe2+ | |
| B. | 正极发生的反应为:2H2O+O2+2e-═4OH- | |
| C. | 钢和铁都是铁合金,所以它们的组成基本相同 | |
| D. | 插在水中的钢柱在水下部分比在空气与水交界处更容易腐蚀 |
 在工业上有重要用途,其合成流程如图:
在工业上有重要用途,其合成流程如图:
 .
. .
. +2Ag(NH3)2OH→
+2Ag(NH3)2OH→ +2Ag↓+3NH3+H2O.
+2Ag↓+3NH3+H2O. .
. .
.
 .
.