题目内容
10.常温下向10mL 0.1mol•L-1的HR溶液中逐滴滴入0.1mol•L-1的NH3•H2O溶液,所得溶液pH及导电性变化如下图.下列分析不正确的是( )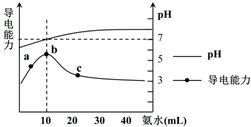
| A. | a~b点导电能力增强说明HR为弱酸 | |
| B. | b点溶液pH=7说明NH4R没有水解 | |
| C. | c 点溶液存在c(NH4+)>c(R-)、c(OH-)>c(H+) | |
| D. | b-c任意点溶液均有c(H+)•c(OH-)=Kw=1.0×10-14 mol2•L-2 |
分析 A.溶液导电能力与离子浓度成正比,如果HR是强电解质,加入氨水至溶液呈中性时,溶液中离子浓度会减小,导致溶液导电能力降低;
B.弱离子在水溶液中会发生水解反应;
C.c点溶液的pH>7,说明溶液呈碱性,溶液中c(OH-)>c(H+),再结合电荷守恒判断;
D.离子积常数只与温度有关,温度不变,离子积常数不变.
解答 解:A.溶液导电能力与离子浓度成正比,如果HR是强电解质,加入氨水至溶液呈中性时,溶液中离子浓度会减小,导致溶液导电能力降低,根据图知,加入氨水至溶液呈中性时随着氨水的加入,溶液导电能力增强,说明离子浓度增大,则HR为弱电解质,故A正确;
B.弱离子在水溶液中会发生水解反应,根据A知,HR是弱电解质,且一水合氨是弱电解质,所以NH4R是弱酸弱碱盐,b点溶液呈中性,且此时二者的浓度、体积都相等,说明HR和一水合氨的电离程度相等,所以该点溶液中铵根离子和酸根离子水解程度相等,故B错误;
C.c点溶液的pH>7,说明溶液呈碱性,溶液中c(OH-)>c(H+),再结合电荷守恒得c(NH4+)>c(R-),故C正确;
D.离子积常数只与温度有关,温度不变,离子积常数不变,所以b-c任意点溶液均有c(H+)•c(OH-)=Kw=1.0×10-14 mol2•L-2,故D正确;
故选B.
点评 本题考查酸碱混合溶液定性判断,为高频考点,明确图中曲线变化趋势及曲线含义是解本题关键,侧重考查学生分析判断及知识综合运用能力,易错选项是D,注意:离子积常数只与温度有关,与溶液浓度及酸碱性无关,题目难度中等.

练习册系列答案
 天天练口算系列答案
天天练口算系列答案
相关题目
6.一定条件下,在容积为10L密闭容器中发生反应:N2(g)+3H2(g)?2NH3(g),30s后测得生成0.04molNH3.在这段时间内H2的化学反应速率为( )
| A. | 0.0004mol/(L•min) | B. | 0.0002mol/(L•s) | C. | 0.0016 | D. | 0.012 mol/(L•min) |
1.在标准状况下充满HCl的烧瓶做完喷泉实验后得到稀盐酸,用标准碳酸钠溶液滴定这种盐酸测定它的准确浓度,请你回答下列问题:
(1)用标准Na2CO3溶液滴定这种盐酸时,Na2CO3溶液应装在碱式滴定管中,若用甲基橙作指示剂,达到滴定终点时,溶液从红色变为橙色.
(2)现配制三种浓度的标准Na2CO3溶液,你认为最合适的是下列第③种(填序号).
①2.500mol•L-1 ②0.25mol•L-1 ③0.025mol•L-1
(3)若采用上述合适浓度的标准Na2CO3溶液滴定,用c(Na2CO3)表示,滴定时实验数据列表如下:
求这种待测稀盐酸的物质的量浓度(用数据和符号列式即可):c(HCl)=1.7c(Na2CO3).
(4)用A.偏高;B.偏低;C.无影响;D.无法判断,填写下列各项操作会给实验造成的误差.
①开始滴定时,滴定管尖端处有气泡,滴定完毕气泡排出A
②滴定前读数时仰视,滴定完毕读数时俯视B.
(1)用标准Na2CO3溶液滴定这种盐酸时,Na2CO3溶液应装在碱式滴定管中,若用甲基橙作指示剂,达到滴定终点时,溶液从红色变为橙色.
(2)现配制三种浓度的标准Na2CO3溶液,你认为最合适的是下列第③种(填序号).
①2.500mol•L-1 ②0.25mol•L-1 ③0.025mol•L-1
(3)若采用上述合适浓度的标准Na2CO3溶液滴定,用c(Na2CO3)表示,滴定时实验数据列表如下:
| 实验编号 | 待测盐酸体积(mL) | 滴入Na2CO3溶液体积(mL) |
| 1 | 20.00 | 18.80 |
| 2 | 20.00 | 16.95 |
| 3 | 20.00 | 17.05 |
(4)用A.偏高;B.偏低;C.无影响;D.无法判断,填写下列各项操作会给实验造成的误差.
①开始滴定时,滴定管尖端处有气泡,滴定完毕气泡排出A
②滴定前读数时仰视,滴定完毕读数时俯视B.
18.碳、氮广泛的分布在自然界中,碳、氮的化合物性能优良,在工业生产和科技领域有重要用途.

(1)氮化硅(Si3N4)是一种新型陶瓷材料,它可由SiO2与过量焦炭在1300~1700°C的氮气流中反应制得:3SiO2(s)+6C(s)+2N2(g)?Si3N4(s)+6CO(g).△H=-1591.2kJ/mol,则该反应每转移1mole-,可放出的热量为132.6kJ.
(2)某研究小组现将三组CO(g)与H2O(g)的混合气体分别通入体积为2L的恒容密闭容器中,一定条件下发生反应:CO(g)+H2O(g)?CO2(g)+H2(g),得到如表数据:
①实验1中,前5min的反应速率v(CO2)=0.15mol/(L.min).
②下列能判断实验2已经达到平衡状态的是ad.
a.容器内CO、H2O、CO2、H2的浓度不再变化 b.容器内压强不再变化
c.混合气体的密度保持不变 d.v正(CO)=v逆(CO2)
e.容器中气体的平均相对分子质量不随时间而变化
③若实验2的容器是绝热的密闭容器,实验测得H2O(g)的转化率H2O%随时间变化的示意图如图1所示,b点v正>v逆(填“<”、“=”或“>”),t3~t4时刻,H2O(g)的转化率H2O%降低的原因是该反应达到平衡后,因反应为放热反应且反应容器为绝热容器,故容器内温度升高,反应逆向进行.
(3)利用CO与H2可直接合成甲醇,下图是由“甲醇-空气”形成的绿色燃料电池的工作原理示意图如图2,写出以石墨为电极的电池工作时负极的电极反应式CH3OH-6e-+H2O=CO2+6H+,利用该电池电解1L 0.5mol/L的CuSO4溶液,当消耗560mLO2(标准状况下)时,电解后溶液的pH=1(溶液电解前后体积的变化忽略不计).

(1)氮化硅(Si3N4)是一种新型陶瓷材料,它可由SiO2与过量焦炭在1300~1700°C的氮气流中反应制得:3SiO2(s)+6C(s)+2N2(g)?Si3N4(s)+6CO(g).△H=-1591.2kJ/mol,则该反应每转移1mole-,可放出的热量为132.6kJ.
(2)某研究小组现将三组CO(g)与H2O(g)的混合气体分别通入体积为2L的恒容密闭容器中,一定条件下发生反应:CO(g)+H2O(g)?CO2(g)+H2(g),得到如表数据:
| 实验组 | 温度/℃ | 起始量/mol | 平衡量/mol | 达平衡所需时间/mol | ||
| CO | H2O | CO | H2 | |||
| 1 | 650 | 2 | 4 | 0.5 | 1.5 | 5 |
| 2 | 900 | 1 | 2 | 0.5 | 0.5 | |
②下列能判断实验2已经达到平衡状态的是ad.
a.容器内CO、H2O、CO2、H2的浓度不再变化 b.容器内压强不再变化
c.混合气体的密度保持不变 d.v正(CO)=v逆(CO2)
e.容器中气体的平均相对分子质量不随时间而变化
③若实验2的容器是绝热的密闭容器,实验测得H2O(g)的转化率H2O%随时间变化的示意图如图1所示,b点v正>v逆(填“<”、“=”或“>”),t3~t4时刻,H2O(g)的转化率H2O%降低的原因是该反应达到平衡后,因反应为放热反应且反应容器为绝热容器,故容器内温度升高,反应逆向进行.
(3)利用CO与H2可直接合成甲醇,下图是由“甲醇-空气”形成的绿色燃料电池的工作原理示意图如图2,写出以石墨为电极的电池工作时负极的电极反应式CH3OH-6e-+H2O=CO2+6H+,利用该电池电解1L 0.5mol/L的CuSO4溶液,当消耗560mLO2(标准状况下)时,电解后溶液的pH=1(溶液电解前后体积的变化忽略不计).
5.现有10种元素的性质、数据如表所列,它们均为短周期元素.
回答下列问题:
(1)D的元素名称是磷,若H的一种同位素中子数为5,则其原子符号是${\;}_{5}^{10}$B,B元素的原子结构示意图是 ;
;
(2)在以上元素形成的最高价氧化物的水化物中,酸性最强的化合物的分子式是HClO4;化合物F2A2的电子式是: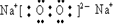 .
.
(3)用电子式表示F2I的形成过程: ;
;
(4)用J元素的单质与A元素的单质可以制成电池,电池中装有KOH浓溶液,用多孔的惰性电极甲和乙浸入KOH溶液,在甲极通入J的单质,乙极通入A的单质,则乙极的电极反应式为:O2+4e-+2H2O=4OH-.
| A | B | C | D | E | F | G | H | I | J | |
| 原子半径 (10-10m) | 0.74 | 1.60 | 1.52 | 1.10 | 0.99 | 1.86 | 0.75 | 0.82 | 1.02 | 0.037 |
| 最高或最低 化合价 | +2 | +1 | +5 | +7 | +1 | +5 | +3 | +6 | +1 | |
| -2 | -3 | -1 | -3 | -2 |
(1)D的元素名称是磷,若H的一种同位素中子数为5,则其原子符号是${\;}_{5}^{10}$B,B元素的原子结构示意图是
 ;
;(2)在以上元素形成的最高价氧化物的水化物中,酸性最强的化合物的分子式是HClO4;化合物F2A2的电子式是:
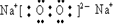 .
.(3)用电子式表示F2I的形成过程:
 ;
;(4)用J元素的单质与A元素的单质可以制成电池,电池中装有KOH浓溶液,用多孔的惰性电极甲和乙浸入KOH溶液,在甲极通入J的单质,乙极通入A的单质,则乙极的电极反应式为:O2+4e-+2H2O=4OH-.
15.下列分子中,键能最小的是( )
| A. | F2 | B. | Br2 | C. | Cl2 | D. | N2 |
19.下列说法中不正确的是( )
| A. | 无机非金属材料中不可能含有金属元素 | |
| B. | 铝盐、铁盐有净水作用,向浑浊的水中加入少量明矾或硫酸铁溶液,搅拌,过一段时间,水的底部会出现很多絮状不溶物,水变澄清透明 | |
| C. | 氯化物在化学工业领域有重要应用,例如SiCl4、GeCl4、TiCl4分别是制取高纯硅、锗和钛的重要中间物质 | |
| D. | 地球上存在的天然二氧化硅形态有结晶形和无定形两大类统称硅石 |
20.下列实验能达到实验目的且符合安全要求的是( )
| A. | 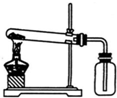 实验室制氧气 | B. | 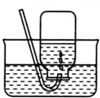 收集氧气 | ||
| C. | 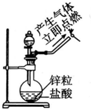 制备并检验氢气的可燃性 | D. | 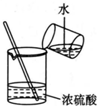 浓硫酸稀释 |