题目内容
20.在一定条件下,甲烷与一氧化碳的燃烧的热化学方程式分别为:CH4(g)+2O2(g)═CO2(g)+2H 2O(l)△H=-890kJ/mol
2CO(g)+O2(g)═2CO2(g)△H=-566.0kJ/mol
一定量的甲烷与一氧化碳的混合气完全燃烧时,放出的热量为262.9kJ,生成的CO2用过量的饱和石灰水完全吸收,可得到50g白色沉淀.求混合气体中甲烷和一氧化碳的体积比2:3.
分析 生成的CO2用过量的饱和石灰水完全吸收,得到50g白色沉淀为CaCO3,根据碳元素守恒可以知道CO和CH4的总物质的量,再根据放出的热量列方程计算解答.
解答 解:设CH4为amol,CO为bmol,
根据碳元素守恒:amol+bmol=$\frac{50g}{100g/mol}$=0.5mol,
由CH4和CO的燃烧的热化学方程式及放出的热量,可得:890kJ/mol×amol+$\frac{566}{2}$kJ/mol×bmol=262.9kJ,
联立方程解得:a=0.2、b=0.3,
则混合气体中CH4和CO的体积比0.2mol:0.3mol=2:3,
故答案为:2:3.
点评 本题考查混合物计算、反应热计算,难度不大,注意对基础知识的理解掌握.

练习册系列答案
 备战中考寒假系列答案
备战中考寒假系列答案
相关题目
16.下列说法正确的是( )
| A. | KCl和SO2溶于水后能导电,故KCl和SO2为电解质 | |
| B. | AgCl沉淀易转化为AgI沉淀,故K(AgI)<K(AgCl) | |
| C. | 电解精炼铜时,粗铜作阴极,纯铜作阳极 | |
| D. | 25℃时,用醋酸溶液滴定等浓度NaOH溶液至pH=7时,两溶液体积:V醋酸<VNaOH |
11.化学与生活、社会发展息息相关,下列说法正确的是( )
| A. | “丹砂(HgS)烧之成水银,积变又还成了丹砂”,该过程发生了氧化还原反应 | |
| B. | 大分子化合物油脂在人体内水解为氨基酸和甘油等小分子才能被吸收 | |
| C. | 利用植物油的氧化反应可以获得人造脂肪 | |
| D. | 干燥剂硅胶和硅橡胶的主要成分都是二氧化硅 |
8.25℃时,下列各组离子在指定溶液中一定能大量共存的是( )
| A. | 0.1mol/L的氯化铁溶液中:Na+、K+、Br-、SCN- | |
| B. | 水电离出的氢氧根离子浓度为10-13mol/L的溶液中:NH4+、K+、SiO32-、SO42? | |
| C. | 使酚酞试液变红色的溶液中:Na+、K+、HCO3-、S2? | |
| D. | 澄清透明的溶液中:K+、Ca2+、MnO4-、NO3- |
15.下列分子中,键能最小的是( )
| A. | F2 | B. | Br2 | C. | Cl2 | D. | N2 |
5.8g O2在标准状况时的体积为(O相对原子质量为16)( )
| A. | 8L | B. | 11.2L | C. | 22.4L | D. | 5.6L |
12.通常用来衡量一个国家的石油化学工业发展水平的标志是( )
| A. | 石油的产量 | B. | 合成纤维的产量 | C. | 乙烯的产量 | D. | 硫酸的产量 |
10.下列叙述正确的是( )
| A. | NaCl的摩尔质量是58.5g | |
| B. | 0.5 mol CO2 中所含的CO2 分子数为 3.01×1023 | |
| C. | 标准状况下,6.02×1022 个CO2 所占的体积约是 22.4 升 | |
| D. | 在 l L 水中溶解5.85g NaCl固体,即可配制得0.1 mo1/L 的NaCl溶液 |
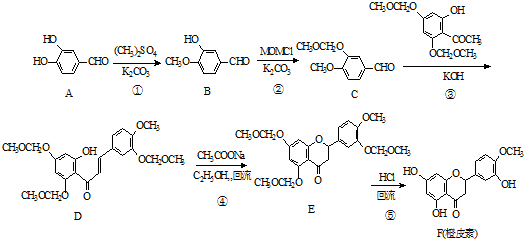
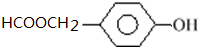 .
.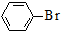 和CH3CHO为原料制备化合物
和CH3CHO为原料制备化合物 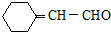 的合成路线流程图(无机试剂可任选).合成路线流程图示例如下:
的合成路线流程图(无机试剂可任选).合成路线流程图示例如下: