题目内容
下列化学用语正确的是( )
A、
 | ||
B、某有机物的分子的简易球棍模型如图,分子式为C3H7O2N | ||
C、羟基乙酸(HOCH2COOH)的缩聚物: | ||
| D、铁在元素周期表中位于第4周期第ⅧB 族 |
考点:原子结构示意图,球棍模型与比例模型,元素周期表的结构及其应用
专题:
分析:A.18O2-离子核外有10个电子,有2个电子层,各层电子数为2、8;
B.由球棍模型结合原子成键特点,可知有机物的结构简式为CH3CH(NH2)COOH;
C.依据酯化反应的原理酸去羟基醇去氢判断;
D.Fe的原子序数为26,不属于副族元素.
B.由球棍模型结合原子成键特点,可知有机物的结构简式为CH3CH(NH2)COOH;
C.依据酯化反应的原理酸去羟基醇去氢判断;
D.Fe的原子序数为26,不属于副族元素.
解答:
解:A.18O原子核外有8个电子,有2个电子层,各层电子数为2、6,原子结构示意图为: ,故A错误;
,故A错误;
B.由结构简式可知分子式为C3H7O2N,故B正确;
C.羟基乙酸(HOCH2COOH)的缩聚物: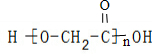 ,故C错误;
,故C错误;
D.Fe的原子序数为26,不属于副族元素,位于周期表第4周期第Ⅷ族,故D错误.
故选B.
 ,故A错误;
,故A错误; B.由结构简式可知分子式为C3H7O2N,故B正确;
C.羟基乙酸(HOCH2COOH)的缩聚物:
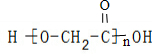 ,故C错误;
,故C错误;D.Fe的原子序数为26,不属于副族元素,位于周期表第4周期第Ⅷ族,故D错误.
故选B.
点评:本题考查了化学用语涉及原子结构示意图、球棍模型、有机物的实验式以及元素周期表的结构及其应用,注意相关知识的学习与积累,难度不大.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
 微型纽扣电池在现代生活中有广泛应用.有一种银锌电池,其电极分别是Ag2O和Zn,电解质溶液为KOH溶液,电极反应为Zn+2OH--2e-═ZnO+H2O,Ag2O+H2O+2e-═2Ag+2OH-.下列叙述正确的是( )
微型纽扣电池在现代生活中有广泛应用.有一种银锌电池,其电极分别是Ag2O和Zn,电解质溶液为KOH溶液,电极反应为Zn+2OH--2e-═ZnO+H2O,Ag2O+H2O+2e-═2Ag+2OH-.下列叙述正确的是( )| A、在使用过程中,电解质KOH被不断消耗 |
| B、使用过程中,电子由Ag2O极经外电路流向Zn极 |
| C、每转移2mol e-,有232gAg2O被氧化 |
| D、Zn是负极,Ag2O是正极 |
已知3375As、3579Br位于同一周期.下列关系正确的是( )
| A、原子半径:As>Cl>P |
| B、热稳定性:HCl>AsH3>HBr |
| C、还原性:As3->S2->Cl- |
| D、酸性:H3AsO4>H2SO4>H3PO4 |
NA表示阿伏加德罗常数,下列叙述正确的是( )
| A、6.4 g铜粉与足量硫粉充分反应,失去的电子数为0.2 NA |
| B、Na2O2与足量H2O反应生成0.2molO2,转移电子的数目为0.4 NA |
| C、标准状况下,22.4 L氯气与足量氢氧化钠溶液反应转移的电子数为2 NA |
| D、0.5 mol?L-1CuCl2溶液中含有Cu2+数小于0.5 NA |
NA表示阿伏加德罗常数,下列说法正确的是( )
| A、标准状况下,22.4L的CCl4中含有的CCl4分子数为NA |
| B、10mL pH=6的纯水中含有OH-离子数为10-10 NA |
| C、100 mL 1 mol?L-1 的Na2CO3溶液中含有CO32-离子数为0.1NA |
| D、14g由N2与CO组成的混合气体含有的原子数目为NA |
某离子反应涉及H2O、ClO-、I03-、OH-、I2、Cl-六种微粒.其中c(ClO-)随反应进行逐渐减小.下列判断错误的是( )
| A、该反应的还原剂是I2 |
| B、氧化剂与还原剂的物质的量之比为5:2 |
| C、消耗lmol氧化剂,转移2mol电子 |
| D、反应后溶液的碱性明显减弱 |
下列反应的离子方程式书写正确的是( )
| A、NaHSO3在水中的电离:NaHSO3═Na++H++SO32- |
| B、碳酸钠水溶液的水解:CO32-+2H2O?H2CO3+2OH- |
| C、向含有Pb2+的工业废水中加入FeS:Pb2++FeS═PbS↓+Fe2+ |
| D、向硫酸铜溶液中滴加过量氨水:Cu2++2NH3?H2O═Cu(OH)2↓+2NH4+ |
