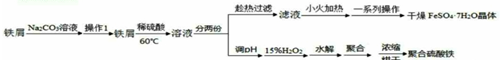
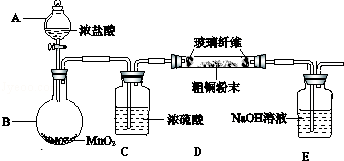
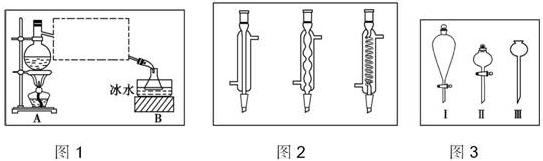
题目内容
7.实验室采用MgC12、AlCl3的混合溶液与过量氨水反应制备MgAl2O4的主要流程如下: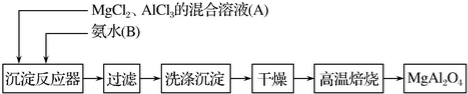
(1)制备MgAl2O4过程中,高温焙烧时发生反应的化学方程式为2Al(OH)3+Mg(OH)2=MgAl2O4+4H2O.
(2)判断流程中沉淀是否洗净所用的试剂是AgNO3溶液(或硝酸酸化的AgNO3溶液).
(3)在25℃下,向浓度均为0.01mol/L的MgC12和AlCl3混合溶液中逐滴加入氨水,先生成Al(OH)3沉淀(填化学式),生成该沉淀的离子方程式:Al3++3NH3•H2O=Al(OH)3↓+3NH4+.
【已知25℃时Ksp[Mg(OH)2]=1.8×10-11,Ksp[Al(OH)3]=3×10-34】
(4)将Mg、Al组成的9.9g混合物投入一定量稀硝酸中,恰好完全反应,共收集到还原产物NO气体6.72L(标准状况),向反应后的溶液中加入4mol/L的Na0H溶液300mL时,则形成沉淀的质量为17.4g.
分析 MgCl2、AlCl3的混合溶液与过量氨水反应生成氢氧化镁和氢氧化铝沉淀,再经过过滤、洗涤、干燥得氢氧化镁和氢氧化铝沉淀,再在高温焙烧得到MgAl2O4固体,
(1)经分析沉淀为Al(OH)3和Mg(OH)2,高温焙烧备MgAl2O4时发生反应生成MgAl2O4和H2O;
(2)根据题意可知,沉淀中应该附着氯离子和铵根离子,若判断是否洗净,可以取少量最后一次洗涤液,加入硝酸酸化的硝酸银溶液进行判断,若生成白色沉淀,则说明没有洗涤干净;若没有沉淀生成,则说明已经洗涤干净;
(3)根据溶度积常数确定先沉淀的物质,Cu2+和Al3+开始沉淀时OH-离子的浓度,开始沉淀时所需OH-离子的浓度越小,离子越先沉淀;
(4)硝酸被还原为NO气体且标准状况下体积为6.72L,即物质的量=$\frac{6.72L}{22.4L/mol}$=0.3mol,根据氮元素的化合价变化计算转移电子物质的量,得到镁铝物质的量,加入4mol/L的Na0H溶液300mL时,分析判断铝离子的存在形式,计算最后生成沉淀的质量.
解答 解:(1)经分析沉淀为Al(OH)3和Mg(OH)2,高温焙烧备MgAl2O4时发生反应生成MgAl2O4和H2O,反应的化学方程式为:2Al(OH)3+Mg(OH)2$\frac{\underline{\;高温\;}}{\;}$MgAl2O4+4H2O;
故答案为:2Al(OH)3+Mg(OH)2=MgAl2O4+4H2O;
(2)沉淀中应该附着氯离子和铵根离子,若判断是否洗净:可以取少量最后一次洗涤液,加入AgNO3溶液(或硝酸酸化的AgNO3溶液)溶液进行判断,若生成白色沉淀,则说明没有洗涤干净,若没有白色沉淀生成,则说明已经洗涤干净,
故答案为:AgNO3溶液(或硝酸酸化的AgNO3溶液);
(3)向0.01mol•L-1的MgCl2中逐滴加入氨水,Ksp[Mg(OH)2]=c(Mg2+)[c(OH-)]2=0.01mol•L-1×[c(OH-)]2=1.8×10-11,c(OH-)=$\sqrt{18}$×10-5,即当溶液中c(OH-)>$\sqrt{18}$×10-5时有Mg(OH)2沉淀生成;
向0.01mol•L-1AlCl3溶液中逐滴加入氨水,Ksp[Al(OH)3]=c(Al3+)[c(OH-)]3=0.01mol•L-1×[c(OH-)]3=3×10-34,c(OH-)=$\root{3}{30}$×10-11,即当溶液中c(OH-)>$\root{3}{30}$×10-11时有Al(OH)3沉淀生成;向浓度均为0.01mol•L-1的MgCl2和AlCl3混合溶液中逐滴加入氨水,应先生成Al(OH)3沉淀,反应离子方程式应为:Al3++3NH3•H2O=Al(OH)3↓+3NH4+;
故答案为:Al(OH)3;Al3++3NH3•H2O=Al(OH)3↓+3NH4+;
(4)硝酸被还原为NO气体且标准状况下体积为6.72L,物质的量为:$\frac{6.72L}{22.4L/mol}$=0.3mol,所以转移的电子的物质的量为:0.3mol×(5-2)=0.9mol,设金属Mg、Al组成的9.9g混合物中MgAl物质的量分别为:x、y,
2x+3y=0.9
24x+27y=9.9
x=0.3mol
y=0.1mol
向反应后的溶液中加入4mol/L的Na0H溶液300mL.n(OH-)=0.3L×4mol/L=1.2mol,
Mg2++2OH-=Mg(OH)2↓
1 2
0.3mol 0.6mol
Al3++3OH-=Al(OH)3↓
1 3 1
0.1mol 0.3mol 0.1mol
剩余氢氧化钠物质的量=1.2mol-0.9mol=0.3mol,
Al(OH)3+OH-=AlO2-+2H2O
0.1mol 0.1mol
最后沉淀为Mg(OH)2,所以最后沉淀质量为:0.3mol×58g/mol=17.4g,
故答案为:17.4.
点评 本题考查物质的制备实验、氧化还原反应定量计算、物质量不同产物不同、溶度积常数计算、物质性质等知识点,试题侧重考查学生的分析、理解能力及化学实验能力,难度中等.

| A. | K=$\frac{{c}^{4}(C){c}^{2}(D)}{{c}^{3}(A){c}^{2}(B)}$ | |
| B. | 增加B,平衡向右移动,B的平衡转化率增大 | |
| C. | 增大该体系的压强,平衡向左移动,化学平衡常数不变 | |
| D. | 此时B的平衡转化率是40% |
| A. | 12C可用于考古断代,推算出文物的年代 | |
| B. | 在一定温度和压强下,气体体积主要取决于气体分子之间的平均间距 | |
| C. | 道尔顿、阿伏伽德罗、卢瑟福、玻尔等科学家的研究不断更新人们对原子结构的认识 | |
| D. | 确定物质中含有哪些金属元素可用原子吸收光谱 |
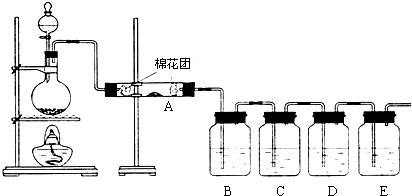
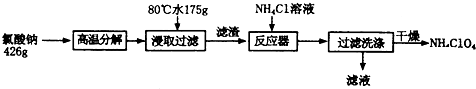
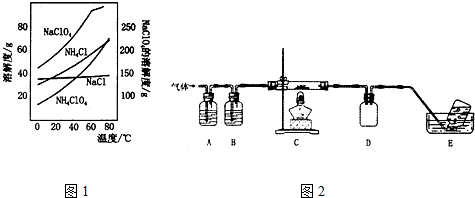
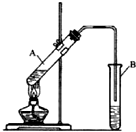 实验室制取乙酸乙酯的反应装置如图所示,请回答下列问题.
实验室制取乙酸乙酯的反应装置如图所示,请回答下列问题.