��Ŀ����
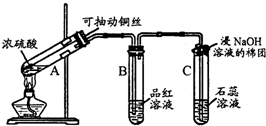
20����ͬѧ��������װ����֤ľ̿��Ũ���ᷴӦ��ȫ������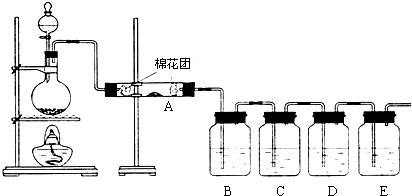
��1��д��ľ̿��Ũ���ᷴӦ�Ļ�ѧ����ʽ��C+2H2SO4��Ũ��$\frac{\underline{\;\;��\;\;}}{\;}$CO2��+2SO2��+2H2O
��2��A�м�����Լ�����ˮCuSO4��ĩ��B��D�м�����Լ�����Ʒ����Һ��D����ȷ��ʵ�������ǣ�Ʒ�첻��ɫ
��3��ʵ��ʱ��C����������ǵ��е��۵ĵ�ˮ���۲쵽����������Һ��ɫ��dz��
���ӷ���ʽΪ��SO2+I2+2H2O=SO42-+2I-+4H+��
����ͬѧֻ��B��C��D��Eװ����֤SO2��ijЩ���ʣ���ش��������⣺
��1��C�м�����Լ��������ᣬ֤��SO2���������ԣ�
��2��D�м������Ե�KMnO4��Һ��֤��SO2���л�ԭ�ԣ�
��3��E�м�����з�̪��NaOH��Һ��֤��SO2���������壮
���� ��1��̼��Ũ�����ڼ��������·�Ӧ���ɶ�����̼�����������ˮ���ݴ�д����Ӧ�Ļ�ѧ����ʽ��
��2����Ӧ�ж�����������̼��ˮ�����˱�����ţ�Ӧ��������ˮ����ͭ����ˮ��Ȼ����Ʒ����Һ���ж��������������Ը��������Һ��ȥ����������Ʒ����Һ������������Ѿ�����������ó���ʯ��ˮ���������̼��
��3�����е��۵ĵ�ˮ����ɫ�����������뵥�ʵⷴӦ��������͵⻯�⣻
��1�����������ܹ������ⷴӦ���ɵ���S��������������������ԣ�
��2�����Ը��������Һ����ǿ�����ԣ��ܹ��������������������ᣬ���ݻ��ϼ۱仯����������������ʣ�
��3����������Ϊ����������ܹ�������������Һ��Ӧ�����������ͨ����з�̪��NaOH��Һ����Һ��ɫ��
��� �⣺��1��̼��Ũ�����ڼ��������·�Ӧ�ķ���ʽΪ��C+2H2SO4��Ũ��$\frac{\underline{\;\;��\;\;}}{\;}$CO2��+2SO2��+2H2O��
�ʴ�Ϊ��C+2H2SO4��Ũ��$\frac{\underline{\;\;��\;\;}}{\;}$CO2��+2SO2��+2H2O��
��2��������Һ�к���ˮ��Ҫ���鷴Ӧ��������ȼ���ˮ��ʹ���Լ�Ϊ��ˮCuSO4��ĩ����������Ͷ�����̼���ܹ�ʹ����ʯ��ˮ����ǣ�����Ӧ���ȼ����������Ȼ������������������������̼������D��Ʒ����Һ����ɫ��֤�����������Ѿ�������
�ʴ�Ϊ����ˮCuSO4��ĩ��Ʒ�첻��ɫ��
��3�����е��۵ĵ�ˮ����ɫ�����������뵥�ʵⷴӦ��������͵⻯�⣬������Һ��ɫ��dz���䷴Ӧ�����ӷ���ʽΪ��SO2+I2+2H2O=SO42-+2I-+4H+��
�ʴ�Ϊ����Һ��ɫ��dz��SO2+I2+2H2O=SO42-+2I-+4H+��
��1���������������ⷴӦ����S���ʣ�����������S�Ļ��ϼ۴�+4�۽�Ϊ0�ۣ�������������������ԣ�����֤��SO2���������ԣ�Ӧ����C�н��������
�ʴ�Ϊ�������
��2������������S�Ļ��ϼ�Ϊ+4�ۣ��ܹ���ǿ���������Ը��������Һ������+6�ۣ���Ӧ�ж�����������˻�ԭ�ԣ�
�ʴ�Ϊ����ԭ��
��3��E�м�����з�̪��NaOH��Һ����Һ����ɫ��֤�����������ܹ�������������Һ��Ӧ�����������Ϊ���������
�ʴ�Ϊ���ᣮ
���� ���⿼����Ũ������C �ķ�Ӧ����Ŀ�Ѷ��еȣ�ע������Ũ����Ļ�ѧ���ʣ��ܹ����ʵ�����C ��Ũ����ķ�Ӧ�����ȷ�����������Ư���ԡ���ԭ�ԡ��������ǽ���Ĺؼ���������ػ���֪ʶ�Ŀ��飬���������ѧ�����Ӧ�û���֪ʶ��������

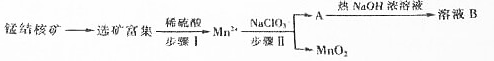
�������ݵĵ����Ũ�Ȼ�������Ksp�����±���
| ������ | Zn��OH��2 | Fe��OH��2 | Fe��OH��3 |
| Ksp����ֵ | 10-17 | 10-17 | 10-39 |
��1�������������0.5molMn2+ʱ����ȥ1mol•L-1��NaClO3��Һ200mL���÷�Ӧ���ӷ���ʽΪ2ClO3-+5Mn2++4H2O=5MnO2+8H++Cl2��
��2����֪��ҺB������֮һ��ѭ���������������������ʵ�������������
��3��MnO2�Ǽ���п�̵�ص��������ϣ��ŵ���̲���MnOOH���õ�������ĵ缫��Ӧʽ��MnO2+H2O+e-�TMnOOH+OH-�����ά�ֵ���ǿ��Ϊ5A����ع���5���ӣ���������п0.5g����֪F=96500C/mol��
��4����Ͼ�п�̵���ڵĻ�����Ҫ�ɷ�MnOOH��Zn��OH��2���м���һ������ϡ�����ϡ���ᣨH2C2O4���������Ͻ�������CO2����Ϊֹ��д��MnOOH���뷴Ӧ�����ӷ���ʽΪ2MnOOH+H2C2O4+2H2SO4=2CO2��+2MnSO4+4H2O����������Һ�еμӸ��������Һ������ɫ���������ʵ��֤����ɫ�¶��ɷ�ΪMnO2ȡ������ɫ��������Թ��У���������Ũ���Ტ���ȣ���������ɫ���壬˵����ɫ����ΪMnO2
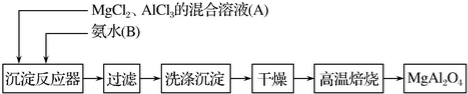
��5���÷Ͼɵ�ص�пƤ����ZnSO4•7H2O�Ĺ����У����ȥпƤ�����������������䷽���ǣ�����ϡH2SO4��H2O2�����ܽ��ΪFe3+���Ӽ��pHΪ2.7ʱ�����պó�����ȫ������Ũ��С��1��10-5mol•L-1ʱ��������Ϊ�����ӳ�����ȫ������������pHΪ6ʱ��п��ʼ�������ٶ�Zn2+Ũ��Ϊ0.1mol•L-1�������������̲���H2O2��������ԭ����Zn��OH��2��Fe��OH��2��Ksp�����Zn2+��Fe2+���벻����
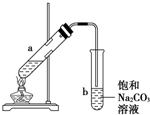 ��ͼΪʵ������ȡ��������������װ��ͼ�����й��ڸ�ʵ��������У�����ȷ���ǣ�������
��ͼΪʵ������ȡ��������������װ��ͼ�����й��ڸ�ʵ��������У�����ȷ���ǣ�������| A�� | ��a�Թ����ȼ����Ҵ���Ȼ���ҡ���Թܱ���������Ũ���ᣬ�ټӱ����� | |
| B�� | �Թ�b�е������¶˹ܿڲ��ܽ���Һ���ԭ���Ƿ�ֹʵ������з����������� | |
| C�� | ʵ��ʱ�����Թ�a��Ŀ���Ǽ�ʱ�����������������ӿ췴Ӧ���� | |
| D�� | �ɽ�����̼������Һ��������������Һ |
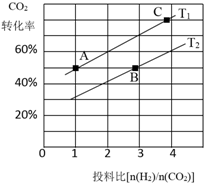 ������̼�IJ����������ҹ���Դ�����һ����Ҫս�Է���
������̼�IJ����������ҹ���Դ�����һ����Ҫս�Է���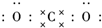 ��������ѧ���������ǹ��ۼ���
��������ѧ���������ǹ��ۼ���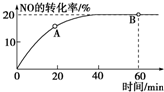 ��1��ij�¶��£����ݻ�Ϊ1L�������г���3mol NO��1mol CO������2NO��g��+2CO��g��???N2��g��+2CO2��g����Ӧ��NO��ת������ʱ��ı仯��ͼ��ʾ��
��1��ij�¶��£����ݻ�Ϊ1L�������г���3mol NO��1mol CO������2NO��g��+2CO��g��???N2��g��+2CO2��g����Ӧ��NO��ת������ʱ��ı仯��ͼ��ʾ��