题目内容
14.近年来科学家研制了一种新型的乙醇电池(DEFC),它用磺酸类质子作溶剂,在200℃左右时供电,乙醇电池比甲醇电池效率高出32倍且更加安全.电池总反应式为:C2H5OH+3O2→2CO2+3H2O.下列说法不正确的是( )| A. | 1mol乙醇被氧化转移6mol电子 | |
| B. | C2H5OH在电池的负极上参加反应 | |
| C. | 在外电路中电子由负极沿导线流向正极 | |
| D. | 电池正极的电极反应式为4H++O2+4e-═2H2O |
分析 A、根据氧化还原反应中化合价的升降来判断电子的转移;
B、在燃料电池中,燃料在负极发生失电子的反应;
C、在外电路中,电子从负极流向正极;
D、在燃料电池中,正极上是氧气得电子的还原反应,据此回答.
解答 解:A、根据电池反应:C2H5OH+3O2=2CO2+3H2O,反应转移电子数为12,所以1mol乙醇被氧化时就有12mol电子转移,故A错误;
B、在燃料电池中,燃料乙醇在负极发生失电子的反应,故B正确;
C、在燃料电池的外电路中,电子由负极沿导线流向正极,和电流的流向相反,故C正确;
D、燃料电池中,正极上是氧气得电子的还原反应,正极的电极反应式为4H++O2+4e-═2H2O,故D正确.
故选A.
点评 本题考查学生原电池的工作原理以及电极反应式的书写、电子转移方向、电子转移的计算等方面的知识,属于综合知识的考查,难度中等.

练习册系列答案
相关题目
4.关于合金的叙述,不正确的是( )
| A. | 合金的熔沸点比原任一金属要高 | B. | 合金的硬度比原任一金属要大 | ||
| C. | 非金属也可以是合金的成分之一 | D. | 合金的用途比纯金属的用途更广 |
9.将等物质的量的X、Y气体充入一个密闭容器中,在一定条件下发生如下反应并达到平衡:X(g)+Y(g)═2Z(g)△H<0.当改变某个条件并达到新平衡后,下列叙述正确的是( )
| A. | 升高温度,X的物质的量减小 | |
| B. | 增大压强(缩小容器体积),Z的浓度不变 | |
| C. | 保持容器体积不变,充入一定量的惰性气体,Y的浓度不变 | |
| D. | 保持容器体积不变,充入一定量的Z,重新平衡时,Y的体积分数增大 |
6.下列反应的离子方程式不正确的是( )
| A. | Ba(OH)2溶液中加入过量Al2(SO4)3溶液:3Ba2++6OH-+2Al3++3SO42-═3BaSO4↓+2Al(OH)3↓ | |
| B. | FeCl3溶液中加入少量Na2S溶液:2Fe3++S2-═2Fe2++S↓ | |
| C. | 将适量CO2通入NaClO溶液中(已知次氯酸的K1为2.95×10-8)ClO-+CO2+H2O=HCO3-+HClO | |
| D. | 向Ca(OH)2溶液中加入过量的NaHCO3溶液:Ca2++2HCO3-+2OH-═CO32-+CaCO3↓+2H2O |
3. 在密闭容器中发生反应N2O4(g)?2NO2(g)△H=+57kJ•mol-1,在温度为T1、T2时,平衡体系中NO2的体积分数随压强变化曲线如图所示.下列说法正确的是( )
在密闭容器中发生反应N2O4(g)?2NO2(g)△H=+57kJ•mol-1,在温度为T1、T2时,平衡体系中NO2的体积分数随压强变化曲线如图所示.下列说法正确的是( )
 在密闭容器中发生反应N2O4(g)?2NO2(g)△H=+57kJ•mol-1,在温度为T1、T2时,平衡体系中NO2的体积分数随压强变化曲线如图所示.下列说法正确的是( )
在密闭容器中发生反应N2O4(g)?2NO2(g)△H=+57kJ•mol-1,在温度为T1、T2时,平衡体系中NO2的体积分数随压强变化曲线如图所示.下列说法正确的是( )| A. | 反应温度:T1>T2 | B. | a、b两点的平衡常数:Kb>Ka | ||
| C. | a、c两点气体的颜色:a浅,c深 | D. | b、c两点的反应速率:v(b)>v(c) |
4.在实验室,下列试剂中需要用棕色试剂瓶保存的是( )
| A. | 浓硝酸 | B. | 浓硫酸 | C. | 浓盐酸 | D. | 浓氨水 |
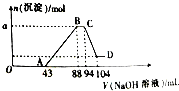 现有一定量铝粉和铁粉的混合物与一定体积稀硝酸充分反应,反应过程中无气体放出(硝酸的还原产物是NH4NO3).在反应结束后的溶液中,逐滴加入2mol?L-1的NaOH溶液,所加NaOH溶液的体积(mL)与产生沉淀的物质的量的关系如图所示.
现有一定量铝粉和铁粉的混合物与一定体积稀硝酸充分反应,反应过程中无气体放出(硝酸的还原产物是NH4NO3).在反应结束后的溶液中,逐滴加入2mol?L-1的NaOH溶液,所加NaOH溶液的体积(mL)与产生沉淀的物质的量的关系如图所示.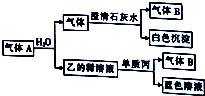 将一黑色固体单质甲投入乙的浓溶液中共热,剧烈反应产生混合气体A,A存在如图转化关系,试回答下列问题:
将一黑色固体单质甲投入乙的浓溶液中共热,剧烈反应产生混合气体A,A存在如图转化关系,试回答下列问题: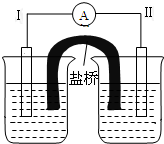 根据反应Fe+Fe2(SO4)3=3FeSO4设计的双液原电池如图所示.
根据反应Fe+Fe2(SO4)3=3FeSO4设计的双液原电池如图所示.