题目内容
19.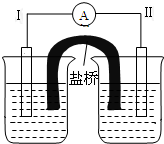 根据反应Fe+Fe2(SO4)3=3FeSO4设计的双液原电池如图所示.
根据反应Fe+Fe2(SO4)3=3FeSO4设计的双液原电池如图所示.①电极Ⅰ的材料为金属铁,则烧杯A中的电解质溶液为FeSO4(填化学式).
②电极Ⅱ发生的电极反应式为Fe3++e-=Fe2+.
分析 ①电解Ⅰ的材料为金属铁,则烧杯A中的电解质溶液为含有亚铁离子的可溶性的盐溶液;
②B烧杯是硫酸铁溶液,溶液中铁离子在电极Ⅱ上得电子,变成亚铁离子.
解答 解:①电解Ⅰ的材料为金属铁,则烧杯A中的电解质溶液为含有亚铁离子的可溶性的盐溶液,可以是硫酸亚铁,
故答案为:FeSO4;
②B烧杯是硫酸铁溶液,溶液中铁离子在电极Ⅱ上得电子,变成亚铁离子,所以Ⅱ发生的电极反应式为:Fe3++e-=Fe2+,
故答案为:Fe3++e-=Fe2+.
点评 本题考查了原电池的有关知识,明确原电池的原理是解本题关键,把握原电池正负极的判断和电极方程式的书写,难度不大.

练习册系列答案
 金牌教辅培优优选卷期末冲刺100分系列答案
金牌教辅培优优选卷期末冲刺100分系列答案
相关题目
9.下列溶液中,Na+浓度最大的是( )
| A. | 0.5mol/LNaCl溶液 | B. | 1L3mol/LNa2SO4溶液 | ||
| C. | 0.4mol/LNaOH溶液 | D. | 2L0.15mol/LNa3PO4溶液 |
10. 乙酸橙花酯是一种食用香料,其结构简式如图,关于该有机物的叙述中正确的是( )
乙酸橙花酯是一种食用香料,其结构简式如图,关于该有机物的叙述中正确的是( )
①属于芳香族化合物;②不能发生银镜反应;③分子式为C12H20O2;④它的同分异构体可能有酚类;⑤1mol该有机物水解时只能消耗1molNaOH.
 乙酸橙花酯是一种食用香料,其结构简式如图,关于该有机物的叙述中正确的是( )
乙酸橙花酯是一种食用香料,其结构简式如图,关于该有机物的叙述中正确的是( )①属于芳香族化合物;②不能发生银镜反应;③分子式为C12H20O2;④它的同分异构体可能有酚类;⑤1mol该有机物水解时只能消耗1molNaOH.
| A. | ②③⑤ | B. | ①④⑤ | C. | ①②③ | D. | ②③④⑤ |
7.下列说法不正确的是( )
| A. | 用10mL量筒量取6.8mL稀H2SO4 | |
| B. | 用碱式滴定管量取15.80mLKMnO4溶液 | |
| C. | 酸碱中和滴定时,滴定管需用标准液或待测液润洗 | |
| D. | 中和热测定时,氢氧化钠溶液稍过量的目的是为了保证盐酸完全被中和 |
14.近年来科学家研制了一种新型的乙醇电池(DEFC),它用磺酸类质子作溶剂,在200℃左右时供电,乙醇电池比甲醇电池效率高出32倍且更加安全.电池总反应式为:C2H5OH+3O2→2CO2+3H2O.下列说法不正确的是( )
| A. | 1mol乙醇被氧化转移6mol电子 | |
| B. | C2H5OH在电池的负极上参加反应 | |
| C. | 在外电路中电子由负极沿导线流向正极 | |
| D. | 电池正极的电极反应式为4H++O2+4e-═2H2O |
4.下列叙述不正确的是( )
| A. | 标准状况下,22.4LNO与11.2LO2混合,混合气体所含分子数为NA | |
| B. | 1molAl3+含有的核外电子数为10NA | |
| C. | 常温常压下,1mol氮气含有的原子总数为NA | |
| D. | 1L1mol/LFeCl3溶液全部制成胶体,其中含胶粒的数目小于NA |
9.将铁屑溶于过量的稀盐酸后,再加入下列物质,会有Fe3+生成的是( )
| A. | 溴水 | B. | 硫酸锌 | C. | 硝酸钠 | D. | 氯化铜 |

 、④-
、④- 、⑨-
、⑨- ),则该化合物的化学式为:MgCNi3(用元素符号表示).
),则该化合物的化学式为:MgCNi3(用元素符号表示).