题目内容
3.太阳能的开发利用在新能源研究中占据重要地位.单晶硅太阳能电池片在加工时,一般掺杂微量的铜、硼、镓、硒等. 就铜、硼两种元素请回答:(1)基态Cu2+的核外电子排布式为1s22s22p63s23p63d9;已知高温下Cu2O比CuO更稳定,试从铜原子核外电子结构角度解释其原因:亚铜离子价电子排布式为3d10,亚铜离子核外电子处于稳定的全充满状态.
(2)铜与类卤素(CN)2、(SCN)2反应生成Cu( CN)2、Cu( SCN)2.其中类卤素( SCN)2结构式为N≡C-S-S-C≡N.其分子中σ键和π键的个数比为5:4;它对应的酸有两种,理论上硫氰酸(H-S-C≡N)的沸点低于异硫氰酸 (H-N=C=S)的沸点,其原因为异硫氰酸分子间可形成氢键,而硫氰酸不能.
(3)在第二周期中第一电离能介于B和N两元素之间的有Be、C、O(写元素符号).
(4)氮化硼(BN)晶体有多种结构.六方氮化硼是通常存在的稳定结构,具有层状结构,可作高温润滑剂;立方氮化硼是超硬材料,有优异的耐磨性.它们的晶体结构如图1所示.
①关于这两种晶体的说法,正确的是BCEF(填序号).
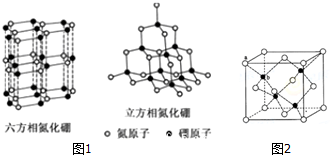
A.立方氮化硼含有σ键和π键,所以硬度大
B.六方氮化硼层间作用力小,所以质地软
C.两种晶体中B-N键均为共价键
D.两种晶体均为分子晶体
E.立方氮化硼晶体,硼原子的杂化轨道类型为sp3
F.六方氮化硼晶体结构与石墨相似却不导电,原因是其层结构中没有自由电子
②图2是立方氮化硼晶胞模型,a位置N原子与b位置B原子之间的距离为a cm,则该晶体的密度为$\frac{75\sqrt{3}}{16{a}^{3}{N}_{A}}$g/cm3(用含a的代数式表示,NA 表示阿伏伽德罗常数).
分析 (1)Cu是29号元素,其原子核外有29个电子,Cu原子失去一个4s电子、一个3d电子生成二价铜离子,根据构造原理书写二价基态铜离子的电子排布式;原子轨道中电子处于半满、全满、全空时最稳定;
(2)铜与类卤素(SCN)2反应生成Cu(SCN)2,SCN分子中硫原子形成两个共用电子对、C原子形成四个共用电子对、N原子形成三个共用电子对;能形成分子间氢键的物质熔沸点较高,异硫氰酸分子间可形成氢键,而硫氰酸不能形成分子间氢键;
(3)同周期主族元素中第ⅡA族和ⅤA族元素比相邻的元素的第一电离能高,所以在第二周期中第一电离能介于B和N两元素之间的有Be、C、O;
(4)①A.立方相氮化硼中N原子与B原子之间形成单键;
B.六方相氮化硼层间作用力为范德华力;
C.两种晶体中的B-N键均为共价键;
D.立方相氮化硼是超硬材料,有优异的耐磨性,属于原子晶体;
E.立方氮化硼晶体中每个硼原子形成4个σ键,所以硼原子的杂化轨道类型为sp3
F.六方氮化硼晶体结构其层结构中没有自由电子,所以不导电;
②立方氮化硼晶胞中应该含有4个N和4个B原子.一个晶胞中的质量为 $\frac{25g}{{N}_{A}}$,a位置N原子与b位置B原子之间的距离为a cm,所以一个立方氮化硼晶胞的体积是$\frac{16{a}^{3}}{3\sqrt{3}}$cm3,根据ρ=$\frac{m}{V}$计算密度.
解答 解:(1)Cu是29号元素,其原子核外有29个电子,Cu原子失去一个4s电子、一个3d电子生成二价铜离子,根据构造原理书写二价铜离子的电子排布式为1s22s22p63s23p63d9;原子轨道中电子处于半满、全满、全空时最稳定,二价铜离子价电子排布式为3d9、亚铜离子价电子排布式为3d10,亚铜离子核外电子处于稳定的全充满状态,所以较稳定,
故答案为:1s22s22p63s23p63d9;亚铜离子价电子排布式为3d10,亚铜离子核外电子处于稳定的全充满状态;
(2)铜与类卤素(SCN)2反应生成Cu(SCN)2,SCN分子中硫原子形成两个共用电子对、C原子形成四个共用电子对、N原子形成三个共用电子对,( SCN)2结构式为N≡C-S-S-C≡N,每个分子中含有4个π键,则1mol(SCN)2中含有σ键数目为5mol,π键的数目为4mol,所以分子中σ键和π键的个数比为5:4;能形成分子间氢键的物质熔沸点较高,异硫氰酸分子间可形成氢键,而硫氰酸不能形成分子间氢键,所以异硫氰酸熔沸点高于硫氰酸,
故答案为:5:4;异硫氰酸分子间可形成氢键,而硫氰酸不能;
(3)同周期主族元素中第ⅡA族和ⅤA族元素比相邻的元素的第一电离能高,所以在第二周期中第一电离能介于B和N两元素之间的有Be、C、O,故答案为:Be、C、O;(4)①A.立方相氮化硼中N原子与B原子之间形成单键,所以无π键,故错误;
B.六方相氮化硼层间作用力为范德华力,故正确;
C.两种晶体中的B-N键均为共价键,故正确;
D.立方相氮化硼是超硬材料,有优异的耐磨性,属于原子晶体,故错误;
E.立方氮化硼晶体中每个硼原子形成4个σ键,所以硼原子的杂化轨道类型为sp3,故正确;
F.六方氮化硼晶体结构其层结构中没有自由电子,所以不导电,故正确;故选:BCEF;
②立方氮化硼晶胞中应该含有4个N和4个B原子.一个晶胞中的质量为 $\frac{25g}{{N}_{A}}$,a位置N原子与b位置B原子之间的距离为a cm,所以一个立方氮化硼晶胞的体积是$\frac{16{a}^{3}}{3\sqrt{3}}$cm3,根据ρ=$\frac{m}{V}$=$\frac{\frac{25}{{N}_{A}}}{\frac{16{a}^{3}}{3\sqrt{3}}}$=$\frac{75\sqrt{3}}{16{a}^{3}{N}_{A}}$,故答案为:$\frac{75\sqrt{3}}{16{a}^{3}{N}_{A}}$.
点评 本题是对物质结构的考查,考查较为全面,涉及电离能大小、化学键的类型、杂化类型的判断以及有关晶体的计算,题目难度中等.

 一线名师提优试卷系列答案
一线名师提优试卷系列答案| A. | 半导体行业中有一句话:“从沙滩到用户”,计算机芯片的材料是二氧化硅 | |
| B. | 为了防止蛋白质盐析,疫苗等生物制剂应冷冻储存 | |
| C. | PM2.5是指大气中直径接近2.5×10-6m的颗粒物,它分散在空气中形成胶体 | |
| D. | 人体内没有能使纤维素水解成葡萄糖的酶,因此纤维素不能作为人类的营养食物 |
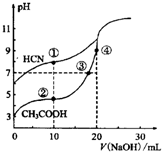
| A. | 点①和点②所示溶液中:c(CH3COO-)<c(CN-) | |
| B. | 点①和点②所示溶液中:c(CH3COO-)-c(CN-)=c(HCN)-c(CH3COOH) | |
| C. | 点③和点④所示溶液中:c(Na+)>c(OH-)>c(CH3COO-)>c(H+) | |
| D. | 点②和点③所示溶液中都有:c(CH3COO-)+c(OH-)=c(CH3COOH)+c(H+) |
| A. | 稀硫酸与氢氧化钡溶液反应 | B. | 稀硝酸与烧碱溶液反应 | ||
| C. | 醋酸与氢氧化钾溶液反应 | D. | 盐酸与氢氧化铁反应 |
| A. | 阿司匹林只有解热镇痛有作用,只能用于治疗感冒 | |
| B. | 青霉素是消炎药,有阻止多种细菌生长的优异功能.使用前一定要进行皮肤敏感试验 | |
| C. | 抗酸药能中和胃液中过多的盐酸,缓解胃部不适的症状 | |
| D. | 天然药物取自植物、动物和矿物,来源丰富,有广阔的开发前景 |
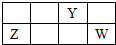 短周期元素X、Y、Z、W的原子序数依次增大,X、Y原子最外层电子数之和等于W原子最外层电子数,Y、Z的最高正化合价之和为8.部分元素在周期表中的相对位置如右图所示.下列说法中正确的是( )
短周期元素X、Y、Z、W的原子序数依次增大,X、Y原子最外层电子数之和等于W原子最外层电子数,Y、Z的最高正化合价之和为8.部分元素在周期表中的相对位置如右图所示.下列说法中正确的是( )| A. | ZY晶体熔化、ZCl3溶于水破坏的化学键种类相同 | |
| B. | 化合物YCl3水解产物之一具有强氧化性,由此可知Y在该化合物中的化合价为+3 | |
| C. | 元素R与W同主族,且原子序数小于W.因为R的非金属性强于W,所以X2R的沸点高于X2W | |
| D. | Z2W3固体可由溶液中复分解反应制得 |
| A. | CO2、SO2、NH3都是直线形分子 | |
| B. | CO2、NH3、H2S 的键角依次减小 | |
| C. | H2O2、N2H4分子的中心原子都是 sp3杂化 | |
| D. | C、N、F元素的电负性依次增大 |
 X、Y、Z、W是元素周期表前四周期中的四种常见元素,其相关信息如下表:
X、Y、Z、W是元素周期表前四周期中的四种常见元素,其相关信息如下表:| 元素 | 相关信息 |
| X | X的基态原子核外3个能级上有电子,且每个能级上的电子数相等 |
| Y | 常温常压下,Y单质是淡黄色固体,常在火山口附近沉积 |
| Z | Z和Y同周期,Z的电负性大于Y |
| W | W的一种核素的质量数为63,中子数为34 |
(2)XY2是一种常用的溶剂,XY2的分子中存在2个σ键.在H-Y、H-Z两种共价键中,键的极性较强的是H-Cl,键长较长的是H-S.
(3)W的基态原子价电子排布式是3d104s1.
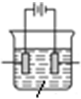
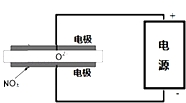
工业上以W2Y为原料制备W的化学方程式为Cu2S+2O2$\frac{\underline{\;高温\;}}{\;}$2Cu+2SO2 ,通过该方法冶炼得到的W的单质含有锌、铁、镍、银、金等杂质,除去这些杂质常用的方法叫电解精炼,请标出右图所示装置中电极材料名称及电解质溶液名称.
(4)W形成的氧化物W2O为半导体材料,在其立方晶胞内部有4个氧原子,其余氧原子位于面心和顶点,则该晶胞中有16个W原子.
 2015年8月12日天津港特大爆炸事故,再一次引发了人们对环境问题的关注.据查危化仓库中存有大量的钠、钾、白磷(P4)、硝酸铵和氰化钠(NaCN).
2015年8月12日天津港特大爆炸事故,再一次引发了人们对环境问题的关注.据查危化仓库中存有大量的钠、钾、白磷(P4)、硝酸铵和氰化钠(NaCN).