题目内容
6.由铜、锌和稀硫酸组成的原电池工作时,下列说法正确的是( )| A. | 电能转化为化学能 | B. | 铜片上产生大量的气泡 | ||
| C. | 原电池中锌是正极,发生氧化反应 | D. | 溶液的pH值减小 |
分析 在用锌片、铜片和稀硫酸组成的原电池装置中,锌片的活泼性大于铜片的活泼性,所以锌片作负极,负极上锌失电子发生氧化反应,铜片作正极,正极上氢离子得电子发生还原反应,以此解答该题.
解答 解:A.在用锌片、铜片和稀硫酸组成的原电池装置,是将化学能转化为电能,故A错误;
B.铜片作正极,正极上氢离子得电子发生还原反应,反应为2H++2e-=H2↑,故B正确;
C.铜片作正极,正极上氢离子得电子发生还原反应,故C错误;
D.氢离子浓度减小,溶液的pH值增大,故D错误.
故选B.
点评 本题考查原电池知识,为高频考点,侧重于学生的分析能力的考查,注意把握原电池的组成条件和工作原理,把握电极的判断和电极方程式的书写,难度不大.

练习册系列答案
相关题目
16.下列实验事实不能用氢键来解释的是( )
| A. | 冰的密度比水小,能浮在水面上 | |
| B. | 接近沸点的水蒸气的相对分子质量测量值大于18 | |
| C. | 邻羟基苯甲醛的沸点低于对羟基苯甲醛 | |
| D. | H2O比H2S稳定 |
17.丹参素能明显抑制血小板的聚集,其结构如图所示,下列说法正确的是( )
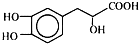

| A. | 丹参素在C上取代H的一氯代物有4种 | |
| B. | 在Ni催化下1 mol丹参素最多可与4 mol H2加成 | |
| C. | 丹参素能发生取代、消去、中和、氧化等反应 | |
| D. | 1 mol丹参素在一定条件下与足量金属钠反应可生成4 mol H2 |
14.常温下,用0.10mol•L-1NaOH溶液分别滴定20.00mL浓度均为0.10mol•L-1CH3COOH溶液和HCN溶液所得滴定曲线如图.下列说法正确的是( )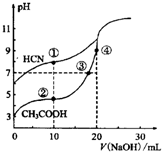

| A. | 点①和点②所示溶液中:c(CH3COO-)<c(CN-) | |
| B. | 点①和点②所示溶液中:c(CH3COO-)-c(CN-)=c(HCN)-c(CH3COOH) | |
| C. | 点③和点④所示溶液中:c(Na+)>c(OH-)>c(CH3COO-)>c(H+) | |
| D. | 点②和点③所示溶液中都有:c(CH3COO-)+c(OH-)=c(CH3COOH)+c(H+) |
1.常温下,向10mL 0.1mol/L的HR溶液中逐滴滴入0.1mol/L的NH3•H2O溶液,所得溶液pH及导电性变化如图.下列分析正确的是( )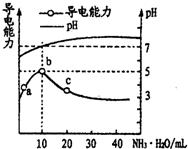

| A. | HR为强酸 | |
| B. | a、b、c三点所示溶液中水的电离程度相同 | |
| C. | b点溶液中c(NH4+)>c(R-)>c(OH-)>c(H+) | |
| D. | a~c任意点溶液均有c(H+)×c(OH-)=Kw=l.0×l0-14 |
11.下列反应中,能用H++OH-═H2O 表示其反应的本质的是( )
| A. | 稀硫酸与氢氧化钡溶液反应 | B. | 稀硝酸与烧碱溶液反应 | ||
| C. | 醋酸与氢氧化钾溶液反应 | D. | 盐酸与氢氧化铁反应 |
18.下列关于药物的叙述中,错误的是( )
| A. | 阿司匹林只有解热镇痛有作用,只能用于治疗感冒 | |
| B. | 青霉素是消炎药,有阻止多种细菌生长的优异功能.使用前一定要进行皮肤敏感试验 | |
| C. | 抗酸药能中和胃液中过多的盐酸,缓解胃部不适的症状 | |
| D. | 天然药物取自植物、动物和矿物,来源丰富,有广阔的开发前景 |
15.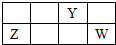 短周期元素X、Y、Z、W的原子序数依次增大,X、Y原子最外层电子数之和等于W原子最外层电子数,Y、Z的最高正化合价之和为8.部分元素在周期表中的相对位置如右图所示.下列说法中正确的是( )
短周期元素X、Y、Z、W的原子序数依次增大,X、Y原子最外层电子数之和等于W原子最外层电子数,Y、Z的最高正化合价之和为8.部分元素在周期表中的相对位置如右图所示.下列说法中正确的是( )
 短周期元素X、Y、Z、W的原子序数依次增大,X、Y原子最外层电子数之和等于W原子最外层电子数,Y、Z的最高正化合价之和为8.部分元素在周期表中的相对位置如右图所示.下列说法中正确的是( )
短周期元素X、Y、Z、W的原子序数依次增大,X、Y原子最外层电子数之和等于W原子最外层电子数,Y、Z的最高正化合价之和为8.部分元素在周期表中的相对位置如右图所示.下列说法中正确的是( )| A. | ZY晶体熔化、ZCl3溶于水破坏的化学键种类相同 | |
| B. | 化合物YCl3水解产物之一具有强氧化性,由此可知Y在该化合物中的化合价为+3 | |
| C. | 元素R与W同主族,且原子序数小于W.因为R的非金属性强于W,所以X2R的沸点高于X2W | |
| D. | Z2W3固体可由溶液中复分解反应制得 |
16.有机物X的分子式为C6H12O2,其水解可得到CH3OH,则X的结构有(考虑立体异构)( )种.
| A. | 3种 | B. | 4种 | C. | 5种 | D. | 6种 |