题目内容
18.下列叙述正确的是( )| A. | 铁表面镀铜,铁作阴极 | |
| B. | 钢管与电源正极连接,钢管可被保护 | |
| C. | 原电池中电解质溶液中的阳离子向负极移动 | |
| D. | 在入海口的钢铁闸门上装铜块可防止闸门被腐蚀 |
分析 A.电镀时,镀层作阳极,镀件作阴极;
B.作电解池阳极的金属加速被腐蚀,作电解池阴极的金属被保护;
C.原电池工作时,阳离子向正极移动;
D.作原电池负极的金属加速被腐蚀,作原电池正极的金属被保护.
解答 解:A.电镀时,镀层作阳极,镀件作阴极,在铁上镀铜时,铜作阳极,铁作阴极,故A正确;
B.作电解池阳极的金属加速被腐蚀,作电解池阴极的金属被保护,钢管与电源正极连接,钢管作电解池阳极,加速被腐蚀,故B错误;
C.原电池工作时,阳离子向正极移动,故C错误;
D.作原电池负极的金属加速被腐蚀,作原电池正极的金属被保护,铁、铜和电解质溶液构成原电池,铁易失电子作负极,所以加速被腐蚀,故D错误;
故选A.
点评 本题考查了金属的腐蚀与防护,明确原电池和电解池原理是解本题关键,再结合各个电极上发生的反应来确定金属被保护还是被腐蚀.

练习册系列答案
 举一反三单元同步过关卷系列答案
举一反三单元同步过关卷系列答案
相关题目
9.分别在等体积等pH或等物质的量浓度的盐酸和醋酸溶液中,加入足量锌粉,氢离子浓度c(H+)及氢气的体积V(H2)(同温同压下测定)的变化图示如下,其中正确的是( )
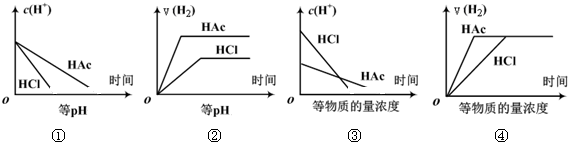

| A. | ①③ | B. | ②④ | C. | ①②③ | D. | ①②③④ |
6.已知A物质的一个分子质量为Wg,氧元素的一种同位素16O的一个原子质量为bg;若以16O原子质量的$\frac{1}{16}$为相对原子质量的标准,以NA 表示阿伏加德罗常数,则关于A分子的相对质量M的计算式正确的是( )
| A. | M=WNA | B. | M=$\frac{16w}{b}$ | C. | M=$\frac{w}{16b}$ | D. | M=$\frac{w}{{N}_{A}}$ |
13.钢铁防腐方法有许多种,如图是其中的一种方法,描述正确的是( )
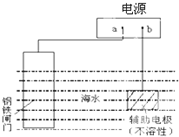

| A. | 图所示是牺牲阳极阴极保护法 | |
| B. | a为电源正极 | |
| C. | 电子流向:a→铁闸门,辅助电极→b | |
| D. | 辅助电极上的反应:O2+2H2O+4e→4OH- |
3.下列表示正确的是( )
| A. | 乙炔分子球棍模型: | B. | Na+的结构示意图为: | ||
| C. | 硝基苯的结构简式: | D. | 羟基的电子式: |
10. 常温下,向20.00ml0.1000mol•L-1(NH4)2SO4溶液中逐滴加入0.2000mol•L-1NaOH时,溶液的pH与所加NaOH溶液体积的关系如图所示(不考虑挥发).下列说法正确的是( )
常温下,向20.00ml0.1000mol•L-1(NH4)2SO4溶液中逐滴加入0.2000mol•L-1NaOH时,溶液的pH与所加NaOH溶液体积的关系如图所示(不考虑挥发).下列说法正确的是( )
 常温下,向20.00ml0.1000mol•L-1(NH4)2SO4溶液中逐滴加入0.2000mol•L-1NaOH时,溶液的pH与所加NaOH溶液体积的关系如图所示(不考虑挥发).下列说法正确的是( )
常温下,向20.00ml0.1000mol•L-1(NH4)2SO4溶液中逐滴加入0.2000mol•L-1NaOH时,溶液的pH与所加NaOH溶液体积的关系如图所示(不考虑挥发).下列说法正确的是( )| A. | 点a所示溶液中:c(NH4+)>c(SO42-)>c(OH-)>c(H+) | |
| B. | 点b所示溶液中:c(NH4+)=c(Na+)>c(H+)=c(OH-) | |
| C. | 点c所示溶液中:c(SO42-)+c(H+)=c(NH3•H2O)+c(OH-) | |
| D. | 点d所示溶液中:c(SO42-)>c(NH3•H2O)>c(NH4+)>c(OH-) |





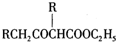 +C2H3OH,请以G为唯一有机试剂合成乙酸乙酯(CH3OCH2COOC2H3),设计合成路线(其他试剂任选),合成路线流程图示例:
+C2H3OH,请以G为唯一有机试剂合成乙酸乙酯(CH3OCH2COOC2H3),设计合成路线(其他试剂任选),合成路线流程图示例:
