题目内容
3.下列表示正确的是( )| A. | 乙炔分子球棍模型: | B. | Na+的结构示意图为: | ||
| C. | 硝基苯的结构简式: | D. | 羟基的电子式: |
分析 A.乙炔分子中含有1个碳碳三键,碳原子的原子半径大于O原子;
B.钠离子的核电荷数为11,不是10;
C.硝基苯中硝基的N原子与苯环相连;
D.羟基为中性原子团, 为氢氧根离子的电子式.
为氢氧根离子的电子式.
解答 解:A.乙炔分子中含有碳碳三键,为直线型结构,其球棍模型为: ,故A正确;
,故A正确;
B.钠离子的核电荷数为11,核外电子总数为10,最外层满足8电子稳定结构,钠离子正确的结构示意图为: ,故B错误;
,故B错误;
C.硝基写在苯环的左边时,应该表示为O2N-,硝基苯正确的结构简式为: ,故C错误;
,故C错误;
D. 为氢氧根离子的电子式,羟基为中性原子团,其正确的电子式为
为氢氧根离子的电子式,羟基为中性原子团,其正确的电子式为 ,故D错误;
,故D错误;
故选A.
点评 本题考查了常见化学用语的表示方法,题目难度中等,涉及电子式、离子结构示意图、球棍模型、结构简式等知识,明确常见化学用语的概念及书写原则为解答关键,试题有利于提高学生的分析能力及规范答题能力.

练习册系列答案
 冲刺100分1号卷系列答案
冲刺100分1号卷系列答案 期末好成绩系列答案
期末好成绩系列答案
相关题目
13.浓硫酸露置在空气中质量增加( )
| A. | 氧化性 | B. | 吸水性 | C. | 脱水性 | D. | 高沸点 |
14.用NA表示阿伏加德罗常数,下列叙述正确的是( )
| A. | 含0.1molHCl溶液中含氢元素0.1NA | |
| B. | 22.4 L 水蒸气含原子数为3NA | |
| C. | 3.4g H2O2中含有的共用电子对数为0.1 NA | |
| D. | 标准状况下,1mol辛烷含有的氢原子数为18NA |
11.仅能在水溶液中导电的电解质是( )
| A. | KOH | B. | KCl | C. | CO2 | D. | NH4HCO3 |
18.下列叙述正确的是( )
| A. | 铁表面镀铜,铁作阴极 | |
| B. | 钢管与电源正极连接,钢管可被保护 | |
| C. | 原电池中电解质溶液中的阳离子向负极移动 | |
| D. | 在入海口的钢铁闸门上装铜块可防止闸门被腐蚀 |
8.下列说法正确的是( )
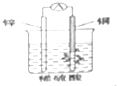

| A. | 构成原电池的两个电极必须是活泼性不同的两种金属 | |
| B. | 右图原电池中,电流由锌棒经外电路流向铜棒 | |
| C. | 通过构成原电池,能将反应的化学能全部转化为电能 | |
| D. | 银锌纽扣电池的放电反应:Zn+Ag2O+H2O=Zn(OH)2+2Ag,其中Ag2O作正极,发生还原反应 |
15.下列说法正确的是( )
| A. | Si、P、S、Cl相应的最高价氧化物对应水化物的酸性依次增强 | |
| B. | 自然界中含有大量的游离态的硅,纯净的硅晶体可用于制作计算机芯片 | |
| C. | 工业上通常用电解钠、铁、铜对应的氯化物制得该三种金属单质 | |
| D. | 钠与氧气反应的产物与反应条件无关 |
5.下列有关物质用途的说法,正确的是( )
| A. | 二氧化硫常用于食品漂白 | |
| B. | 碳酸氢钠常用于焙制糕点 | |
| C. | 氢氧化铝可作耐高温材料 | |
| D. | 氧化钠常用作呼吸面具中的氧气来源 |
6.常温常压下,一定量的甲烷在足量的氧气中完全燃烧生成9g水,该反应中有关物质的物理量描述正确的是( )(NA表示阿伏加德罗常数)
| A. | 电子转移的物质的量为1mol | |
| B. | 断裂了1mol C-H键,转移的电子数目为2NA | |
| C. | 有4gCH4参加反应,生成了5.6L的CO2 | |
| D. | 1mol CH4 (g)和2molO2(g)的能量总和大于1mol CO2 (g)和2molH2O的能量总和 |