题目内容
1.车辆碰撞瞬间,安全装置通电点火,使其中的粉末分解释放出大量保护气形成安全气囊.经分析确定气囊中粉末含有Na、Fe、N、O四种元素.(1)铁元素在周期表中位置第四周期VIII族,氧原子最外层电子排布式为2s22p4.
(2)上述主族元素中,简单离子半径最小的是Na+(写微粒符号);气态氢化物之间发生反应的相关方程式为NH3+H2O?NH3•H2O?NH4++OH-.
(3)气囊粉末中能释放出保护气的化合物由两种短周期元素组成,且2mol 该物质分解可产生3mol非金属单质和2mol 金属单质.该化合物的化学式为NaN3,晶体类型是离子晶体.
(4)下列能用于判断氮、氧两种元素非金属性强弱的是ad(填序号).
a.气态氢化物稳定性 b.最高价氧化物对应水化物酸性强弱
c.单质沸点高低 d.在氮氧化物中,氧显负价,氮显正价.
分析 (1)根据铁元素的原子序数判断所在的位置,氧原子核外电子是8个,据此书写最外层电子排布式;
(2)电子层越多,半径越大,电子层一样多,质子数越大,半径越小;氨气和水之间反应生成一水合氨,一水合氨属于弱碱,可以电离产生铵根离子和氢氧根离子;
(3)2mol 该物质分解可产生3mol非金属单质和2mol 金属单质,1mol化合物含有3mol非金属、1mol金属,应为NaN3;
(4)判断非金属强弱的方法很多,非金属的最高价氧化物的水化物的酸性强弱,能证明非金属强弱;非金属氢化物的稳定性,能说明非金属性强弱;非金属与氢气化合的难易程度,能说明非金属性的强弱.
解答 (1)铁元素的原子序数是26,判周期表中所在的位置:第四周期VIII族,氧原子核外电子是8个,最外层是6个,最外层电子排布式为:2s22p4;故答案为:第四周期VIII族;2s22p4;
(2)Na、Fe、N、O四种元素的离子,电子层越少,半径越小,电子层一样多,质子数越大,半径越小,所以半径最小的离子是Na+;氨气和水之间反应生成一水合氨,一水合氨属于弱碱,可以电离产生铵根离子和氢氧根离子,即NH3+H2O?NH3•H2O?NH4++OH-;
故答案为:Na+;NH3+H2O?NH3•H2O?NH4++OH-;
(3)2mol 该物质分解可产生3mol非金属单质和2mol 金属单质,1mol化合物含有3mol非金属、1mol金属,应为NaN3,该化合物属于离子化合物,是离子晶体,故答案为:NaN3;离子晶体;
(4)a.气态氢化物越稳定,元素的非金属性越强,故正确;
b.最高价氧化物对应水化物的酸性强,元素的非金属性越强,但是氧元素没有最高价含氧酸,故错误;
c.单质沸点高低属于物理性质,元素的非金属性是化学性质,故错误;
d.在氮氧化物中,氧显负价,氮显正价,元素的非金属性强,得电子能量强,易表现负价,故正确.
故选ad.
点评 本题考查考查较为综合,涉及元素化合物、化合物晶体类型,微粒半径大小比较等知识,侧重于化学与生活、生产的考查,难度中等,需要学生具备扎实的基础与灵活运用能力.

| A. | 铁表面镀铜,铁作阴极 | |
| B. | 钢管与电源正极连接,钢管可被保护 | |
| C. | 原电池中电解质溶液中的阳离子向负极移动 | |
| D. | 在入海口的钢铁闸门上装铜块可防止闸门被腐蚀 |
| A. | 与足量酸反应:离子方程式相同 | |
| B. | 热稳定性:Na2CO3<NaHCO3 | |
| C. | 常温下在水中的溶解度:Na2CO3>NaHCO3 | |
| D. | 等物质的量与足量酸反应产生CO2的质量:Na2CO3<NaHCO3 |
| A. | 只有第ⅡA族元素的原子最外层有2个电子 | |
| B. | L电子层为奇数的所有元素都是非金属 | |
| C. | 第三、四、五、六周期元素的数目分别是18、18、32、32 | |
| D. | 由左至右第8、9、10三列元素中没有非金属元素 |
| A. | 食盐 | B. | 油脂 | C. | 氨基酸 | D. | 蛋白质 |
| A. | 电子转移的物质的量为1mol | |
| B. | 断裂了1mol C-H键,转移的电子数目为2NA | |
| C. | 有4gCH4参加反应,生成了5.6L的CO2 | |
| D. | 1mol CH4 (g)和2molO2(g)的能量总和大于1mol CO2 (g)和2molH2O的能量总和 |
| A. | 氯化镁溶液与氨水反应:Mg2++2OH-→Mg(OH)2↓ | |
| B. | 向Na2CO3溶液中滴入酚酞溶液,溶液变红:CO32--+H2O?HCO3-+OH- | |
| C. | 向Ca(HCO3)2溶液中滴加过量的NaOH溶液:Ca2++2HCO3-+2OH-→CaCO3↓+CO32-+2H2O | |
| D. | 向Fe(OH)3悬浊液中加入氢碘酸:Fe(OH)3+3H+→Fe3++3H2O |
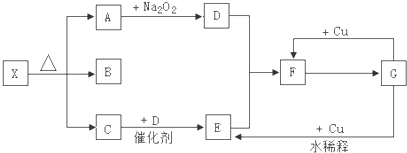
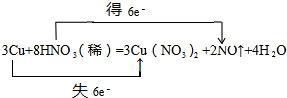 .
.