题目内容
等质量的铝分别与足量的稀盐酸和氢氧化钠溶液反应,两个反应放出的气体在相同状况下体积比为( )
| A、3:1 | B、2:1 |
| C、1:1 | D、1:3 |
考点:离子方程式的有关计算
专题:
分析:Al和HCl、NaOH溶液反应离子方程式分别为2Al+6H+=2Al3++3H2↑、2Al+2H2O+2OH-=2AlO2-+3H2↑,根据铝和氢气之间的关系计算氢气的物质的量,相同条件下气体摩尔体积相等,其体积之比等于物质的量之比.
解答:
解:Al和HCl、NaOH溶液反应离子方程式分别为2Al+6H+=2Al3++3H2↑、2Al+2H2O+2OH-=2AlO2-+3H2↑,HCl和NaOH足量,根据化学式2Al----3H2知,二者生成氢气的物质的量相等,相同条件下气体摩尔体积相等,其体积之比等于物质的量之比,所以气体体积之比为1:1,
故选C.
故选C.
点评:本题考查离子方程式计算,明确铝和氢气的关系式即可解答,如果铝是足量,HCl和NaOH的物质的量相等,相同条件下其生成气体体积不同,注意不足量的物质,为易错题.

练习册系列答案
 活力课时同步练习册系列答案
活力课时同步练习册系列答案
相关题目
下列说法错误的是( )
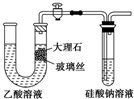

| A、使用如图所示装置验证Ka(CH3COOH)>Ka(H2CO3)>Ka(H2SiO3) |
| B、0.1 mol?L-1的醋酸中加入水或加入冰醋酸均可使平衡向电离方向移动 |
| C、等物质的量浓度的CH3COONa和Na2CO3溶液,后者溶液中水的电离程度大 |
| D、等pH的醋酸和碳酸,分别加水稀释后溶液的pH仍相等,则醋酸中加入水的体积少 |
A、B两元素的原子分别得到2个电子形成稳定结构时,A放出的能量大于B放出的能量;C、D两元素的原子分别失去一个电子形成稳定结构时,D吸收的能量大于C吸收的能量.若A、B、C、D间分别形成化合物时,属于离子化合物可能性最大的是( )
| A、D2A |
| B、C2B |
| C、C2A |
| D、D2B |
在天平两端各放同浓度、同体积的足量盐酸于烧杯中,调整天平后,往左边烧杯中加入3.6g铝粉,为使天平最终达成平衡,应往右端烧杯中加入镁粉的质量是( )
| A、3.6g | B、3.93g |
| C、3.49g | D、3.70g |
下列说法正确的是( )
| A、BF3和NF3的空间构型都为平面三角形 |
| B、互为手性异构体的分子的化学式相同 |
| C、电子从激发态跃迁到基态,形成吸收光谱 |
| D、每个原子轨道,最多容纳两个电子且自旋方向相同 |
正确掌握好化学用语是学好化学的基础,下列有关表述正确的是( )
A、HClO的电子式 |
B、比例模型 :可以表示CH4,也可以表示CCl4 :可以表示CH4,也可以表示CCl4 |
| C、乙烯的结构简式:CH2CH2 |
| D、碳酸氢根电离:HCO3-+H2O?H3O++CO32- |
有甲、乙、丙三种溶液,进行如下操作:

则甲、乙、丙三种溶液可能是( )

则甲、乙、丙三种溶液可能是( )
| A、BaCl2、H2SO4、MgCl2 |
| B、CaCl2、HNO3、AgNO3 |
| C、CaCl2、HNO3、NaCl |
| D、BaCl2、HCl、Na2SO4 |