题目内容
下列说法错误的是( )
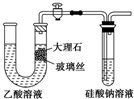

| A、使用如图所示装置验证Ka(CH3COOH)>Ka(H2CO3)>Ka(H2SiO3) |
| B、0.1 mol?L-1的醋酸中加入水或加入冰醋酸均可使平衡向电离方向移动 |
| C、等物质的量浓度的CH3COONa和Na2CO3溶液,后者溶液中水的电离程度大 |
| D、等pH的醋酸和碳酸,分别加水稀释后溶液的pH仍相等,则醋酸中加入水的体积少 |
考点:弱电解质在水溶液中的电离平衡
专题:电离平衡与溶液的pH专题
分析:根据图中实验乙酸与大理石反应有气泡产生,说明乙酸的酸性比碳酸强,但由于乙酸具有挥发性,所以能制得硅酸的不一定是二氧化碳的反应,故不能证明碳酸与硅酸的酸性大小;
A、根据以上分析,不能说明Ka(H2CO3)与Ka(H2SiO3)大小关系;
B、根据影响弱电解质电离平衡的因素分析;
C、溶液中溶质浓度相同,酸越弱,其盐的酸根水解程度越大,据此解答;
D、PH相同时,酸性越弱,酸的浓度越大.
A、根据以上分析,不能说明Ka(H2CO3)与Ka(H2SiO3)大小关系;
B、根据影响弱电解质电离平衡的因素分析;
C、溶液中溶质浓度相同,酸越弱,其盐的酸根水解程度越大,据此解答;
D、PH相同时,酸性越弱,酸的浓度越大.
解答:
解:根据图中实验乙酸与大理石反应有气泡产生,说明乙酸的酸性比碳酸强,但由于乙酸具有挥发性,所以能制得硅酸的不一定是二氧化碳的反应,故不能证明碳酸与硅酸的酸性大小;
A、酸性强的酸能制备酸性弱的酸,已知酸性:CH3COOH>H2SiO3,所以Na2SiO3+CH3COOH=H2SiO3+CH3COONa,故A错误;
B、加水稀释促进弱酸的电离,加冰醋酸会使醋酸的电离平衡正移,故B正确;
C、等物质的量浓度的CH3COONa和Na2CO3溶液,水解显碱性促进水的电离,其阴离子对应的酸越弱,酸根的水解程度越大,根据以上分析酸性:醋酸>碳酸氢根,所以Na2CO3溶液的水解程度比醋酸钠强,水的电离程度大,故C正确;
D、pH相同时,酸性越弱,酸的浓度越大,所以等pH的醋酸和碳酸,酸性:醋酸>碳酸,分别加水稀释后pH仍相等,则醋酸中加入水的体积最少,故D正确;
故选A.
A、酸性强的酸能制备酸性弱的酸,已知酸性:CH3COOH>H2SiO3,所以Na2SiO3+CH3COOH=H2SiO3+CH3COONa,故A错误;
B、加水稀释促进弱酸的电离,加冰醋酸会使醋酸的电离平衡正移,故B正确;
C、等物质的量浓度的CH3COONa和Na2CO3溶液,水解显碱性促进水的电离,其阴离子对应的酸越弱,酸根的水解程度越大,根据以上分析酸性:醋酸>碳酸氢根,所以Na2CO3溶液的水解程度比醋酸钠强,水的电离程度大,故C正确;
D、pH相同时,酸性越弱,酸的浓度越大,所以等pH的醋酸和碳酸,酸性:醋酸>碳酸,分别加水稀释后pH仍相等,则醋酸中加入水的体积最少,故D正确;
故选A.
点评:本题考查了弱酸的电离平衡及影响因素,盐的水解原理的应用等,题目难度不大,侧重于基础知识的考查.

练习册系列答案
相关题目
下列有关实验原理、操作或现象不正确的是( )
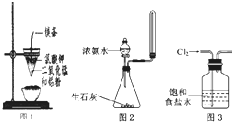

| A、图1装置可制得金属锰,用同样的装置可制得金属铬 |
| B、实验室用图2所示装置制取少量纯净的氨气 |
| C、用玻璃棒蘸取某溶液做焰色反应实验,火焰呈黄色不能说明该溶液中含有钠元素 |
| D、实验室用图3所示装置除去Cl2中的少量HCl |
下列各组有机物中,只需加入溴水就能一一鉴别的是( )
| A、苯、已炔、已烯 |
| B、已烯、苯、四氯化碳 |
| C、已烷、苯、环已烷 |
| D、甲苯、已烷、已烯 |
下表是常温下某些一元弱酸的电离常数:物质的量浓度均为0.1mol?L-1的下列溶液中,pH由大到小的顺序是( )
| 弱酸 | HCN | HF | CH3COOH | HNO2 |
| 电离常数 | 6.2×10-10 | 6.8×10-4 | 1.8×10-5 | 6.4×10-4 |
| A、HCN>HNO2>CH3COOH>HF |
| B、HF>HNO2>CH3COOH>HCN |
| C、HCN>CH3COOH>HNO2>HF |
| D、HCN>CH3COOH>HF>HNO2 |
检验SO42-的存在,最好选用下列物质中的( )
| A、石蕊溶液 | B、碳酸钠溶液 |
| C、硝酸溶液 | D、氯化钡溶液 |
等质量的铝分别与足量的稀盐酸和氢氧化钠溶液反应,两个反应放出的气体在相同状况下体积比为( )
| A、3:1 | B、2:1 |
| C、1:1 | D、1:3 |