题目内容
4.下列叙述不正确的是( )| A. | 标准状况下,22.4LNO与11.2LO2混合,混合气体所含分子数为NA | |
| B. | 1molAl3+含有的核外电子数为10NA | |
| C. | 常温常压下,1mol氮气含有的原子总数为NA | |
| D. | 1L1mol/LFeCl3溶液全部制成胶体,其中含胶粒的数目小于NA |
分析 A、NO和氧气中生成的NO2,而NO2中存在平衡:2NO2?N2O4;
B、铝离子的核外有10个电子;
C、氮气为双原子分子;
D、一个氢氧化铁胶粒是多个氢氧化铁的聚集体.
解答 解:A、标准状况下,22.4LNO即1molNO与11.2LO2即0.5mol氧气混合后,生成1molNO2,而NO2中存在平衡:2NO2?N2O4,故导致分子个数小于NA个,故A错误;
B、铝离子的核外有10个电子,故1mol铝离子中含10mol电子即10NA个,故B正确;
C、氮气为双原子分子,故1mol氮气中含2mol原子即2NA个,故C正确;
D、一个氢氧化铁胶粒是多个氢氧化铁的聚集体,故形成的胶粒个数小于NA个,故D正确.
故选A.
点评 本题考查了阿伏伽德罗常数的有关计算,熟练掌握公式的使用和物质的结构是解题关键,难度不大.

练习册系列答案
相关题目
14.如表各组物质中,Y是X物质中含有的少量杂质,Z是除杂试剂,其中所加试剂最合理的一组是( )
| X | Y | Z | |
| A | NaHCO3溶液 | Na2CO3 | Ba(OH)2溶液 |
| B | Fe2O3 | Al2O3 | NaOH溶液 |
| C | FeCl3溶液 | CuCl2 | Fe |
| D | Na2SO4溶液 | Na2CO3 | 盐酸 |
| A. | A | B. | B | C. | C | D. | D |
15.下列试剂,既能与Na2CO3溶液反应,又能与NaHCO3的是( )
| A. | CaCl2溶液 | B. | BaCl2溶液 | C. | NaOH溶液 | D. | Ba(OH)2溶液 |
12.如表各组溶液电解一段时间后,再加入相关物质,溶液能恢复原来组成的是( )
| 电解质溶液 | 阳极 | 阴极 | 加入的物质 | |
| A | NaCl溶液 | 碳 | 铁 | 盐酸 |
| B | 稀硫酸 | 铜 | 碳 | 水 |
| C | 硫酸铜溶液 | 铜 | 碳 | 硫酸铜 |
| D | NaOH溶液 | 碳 | 铁 | 水 |
| A. | A | B. | B | C. | C | D. | D |
9.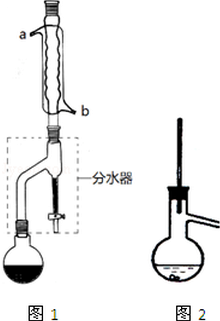 有机物的反应往往伴随副反应发生,因此需要分离提纯.有一种水果香精的合成步骤如下:
有机物的反应往往伴随副反应发生,因此需要分离提纯.有一种水果香精的合成步骤如下:
Ⅰ合成:
在干燥的圆底烧瓶中加11.5mL(9.3g,0.125mL)正丁醇、7.2mL(7.5g,0.125mol)冰醋酸和3~4滴浓H2SO4,摇匀后,加几粒沸石,再按图1所示装置安装好.在分水器中预先加入5.00mL水,其水面低于分水去回流支管下沿3~5mm,然后用小火加热,反应大约40min.
Ⅱ分离提纯:
①将烧瓶中反应后的混合物冷却后与分水器中的酯层合并,转入分液漏斗,依次用10mL水、10mL10%碳酸钠溶液洗至无酸性(pH=7),充分震荡后静置,分去水层.
②将酯层倒入小锥形瓶中,加少量无水硫酸镁干燥
③将乙酸正丁酯粗产品转入50mL蒸馏烧瓶中,加几粒沸石进行常压蒸馏,收集产品,主要试剂及产物的物理常数如表:
制备过程中还可能与的副反应有2CH3CH2CH2CH2OH$?_{△}^{浓H_{2}SO_{4}}$CH3CH2CH2CH2OCH2CH2CH2CH3+H2O
根据以上信息回答下列问题:
(1)合成和分离过程中均使用沸石,其作用防止液体加热时发生暴沸.
(2)如图1整个装置可看作由分水器、圆底烧瓶和冷凝管组成,其中冷水应从b(填a或b)管口通入.
(3)在操作步骤②后(即酯层用无水硫酸镁干燥后),应先过滤(填实验操作名称),然后将乙酸正丁酯粗产品转入蒸馏烧瓶中,如果蒸馏装置如图2所示,则收集到的产品中可能混有正丁醚杂质.
(4)步骤③的常压蒸馏,需控制一定的温度,你认为在bd中加热比较合适(请从下列选项中选择).
A.水 B.甘油(沸点290℃) C.沙子 D.石蜡油(沸点200~300℃)
(5)如何根据装置中的实验现象判断该合成反应达到了终点分水器中水面不再升高.
(6)反应结束后,若放出的水为6.98mL(水的密度为1g/mL),则正丁醇的利用率约为88%.
 有机物的反应往往伴随副反应发生,因此需要分离提纯.有一种水果香精的合成步骤如下:
有机物的反应往往伴随副反应发生,因此需要分离提纯.有一种水果香精的合成步骤如下:Ⅰ合成:
在干燥的圆底烧瓶中加11.5mL(9.3g,0.125mL)正丁醇、7.2mL(7.5g,0.125mol)冰醋酸和3~4滴浓H2SO4,摇匀后,加几粒沸石,再按图1所示装置安装好.在分水器中预先加入5.00mL水,其水面低于分水去回流支管下沿3~5mm,然后用小火加热,反应大约40min.
Ⅱ分离提纯:
①将烧瓶中反应后的混合物冷却后与分水器中的酯层合并,转入分液漏斗,依次用10mL水、10mL10%碳酸钠溶液洗至无酸性(pH=7),充分震荡后静置,分去水层.
②将酯层倒入小锥形瓶中,加少量无水硫酸镁干燥
③将乙酸正丁酯粗产品转入50mL蒸馏烧瓶中,加几粒沸石进行常压蒸馏,收集产品,主要试剂及产物的物理常数如表:
| 化合物 | 正丁醇 | 冰醋酸 | 乙酸正丁酯 | 正丁醚 |
| 密度/(g/mL) | 0.810 | 1.049 | 0.882 | 0.7689 |
| 沸点/℃ | 117.8 | 118.1 | 126.1 | 143 |
| 在水中的溶解性 | 易溶 | 易溶 | 难溶 | 难溶 |
根据以上信息回答下列问题:
(1)合成和分离过程中均使用沸石,其作用防止液体加热时发生暴沸.
(2)如图1整个装置可看作由分水器、圆底烧瓶和冷凝管组成,其中冷水应从b(填a或b)管口通入.
(3)在操作步骤②后(即酯层用无水硫酸镁干燥后),应先过滤(填实验操作名称),然后将乙酸正丁酯粗产品转入蒸馏烧瓶中,如果蒸馏装置如图2所示,则收集到的产品中可能混有正丁醚杂质.
(4)步骤③的常压蒸馏,需控制一定的温度,你认为在bd中加热比较合适(请从下列选项中选择).
A.水 B.甘油(沸点290℃) C.沙子 D.石蜡油(沸点200~300℃)
(5)如何根据装置中的实验现象判断该合成反应达到了终点分水器中水面不再升高.
(6)反应结束后,若放出的水为6.98mL(水的密度为1g/mL),则正丁醇的利用率约为88%.
16.下列有关电解应用,正确的是( )
| A. | 电解精炼铜时,粗铜作阴极 | |
| B. | 电解精炼铜时,溶液浓度基本不变 | |
| C. | 在铁制容器上镀铜时,可用CuSO4溶液作电镀液 | |
| D. | 在铁制容器上镀铜时,铁制容器连接外接电源的正极 |
13.用下列实验装置进行相应实验,能达到实验目的是( )
| A. |  分离乙醇和乙酸混合溶液 | B. |  石油分馏 | ||
| C. |  电解精炼铜 | D. |  实验室用乙醇制取乙烯 |
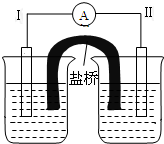 根据反应Fe+Fe2(SO4)3=3FeSO4设计的双液原电池如图所示.
根据反应Fe+Fe2(SO4)3=3FeSO4设计的双液原电池如图所示.