题目内容
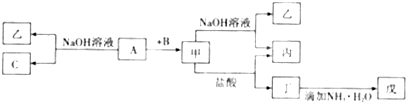
由1-18号元素组成的单质A、B、C和甲、乙、丙、丁、戊五种化合物有图所示转换关系,A是地壳中含量最多的金属.
请回答:
(1)物质的化学式:乙 ,丁 ,戊 .
(2)甲物质在工业上的一种主要用途 .
(3)甲→乙+丙反应的离子方程式 .
(4)A→乙+C反应的化学方程式 .

请回答:
(1)物质的化学式:乙
(2)甲物质在工业上的一种主要用途
(3)甲→乙+丙反应的离子方程式
(4)A→乙+C反应的化学方程式
考点:无机物的推断
专题:推断题
分析:由1-18号元素组成的单质A、B、C,A是地壳中含量最多的金属,则A为Al,Al与氢氧化钠溶液反应生成乙为NaAlO2、C为H2,Al与B反应生成甲,甲能与盐酸、氢氧化钠溶液反应,则B为O2,甲为Al2O3,可推知丙为H2O,丁为AlCl3,戊为Al(OH)3,据此解答.
解答:
解:由1-18号元素组成的单质A、B、C,A是地壳中含量最多的金属,则A为Al,Al与氢氧化钠溶液反应生成乙为NaAlO2、C为H2,Al与B反应生成甲,甲能与盐酸、氢氧化钠溶液反应,则B为O2,甲为Al2O3,可推知丙为H2O,丁为AlCl3,戊为Al(OH)3,
(1)由上述分析可知,乙为NaAlO2,丁为AlCl3,戊为Al(OH)3,故答案为:NaAlO2;AlCl3;Al(OH)3;
(2)甲为Al2O3,在工业上常用冶炼Al,故答案为:冶炼Al;
(3)甲→乙+丙反应的离子方程式为:Al2O3+2OH-=2AlO2-+H2O,故答案为:Al2O3+2OH-=2AlO2-+H2O;
(4)A→乙+C反应的化学方程式为:2Al+2NaOH+2H2O=2 NaAlO2+3H2↑,故答案为:2Al+2NaOH+2H2O=2 NaAlO2+3H2↑.
(1)由上述分析可知,乙为NaAlO2,丁为AlCl3,戊为Al(OH)3,故答案为:NaAlO2;AlCl3;Al(OH)3;
(2)甲为Al2O3,在工业上常用冶炼Al,故答案为:冶炼Al;
(3)甲→乙+丙反应的离子方程式为:Al2O3+2OH-=2AlO2-+H2O,故答案为:Al2O3+2OH-=2AlO2-+H2O;
(4)A→乙+C反应的化学方程式为:2Al+2NaOH+2H2O=2 NaAlO2+3H2↑,故答案为:2Al+2NaOH+2H2O=2 NaAlO2+3H2↑.
点评:本题考查无机物推断,涉及Al元素单质化合物性质,难度不大,注意对基础知识的理解掌握.

练习册系列答案
 每日10分钟口算心算速算天天练系列答案
每日10分钟口算心算速算天天练系列答案
相关题目
下列离子方程式表达正确的是( )
| A、向氯化铁溶液中滴加HI溶液:2Fe3++2HI=2Fe2++2H++I2 |
| B、1mol/L的NaAlO2溶液和2.5 mol/L的HCl等体积均匀混合:2AlO2-+5H+=Al(OH)3↓+Al3++H2O |
| C、向NaAlO2溶液中通入过量CO2制Al(OH)3:2AlO2-+CO2+3H2O=2Al(OH)3↓+CO32- |
| D、将16.8g 铁粉投入100mL 4.0mol/L的HNO3溶液中(还原产物只有NO)6Fe+20H-+5NO3-=3Fe2++3Fe3++5NO↑+10H2O |
某有机物在氧气中充分燃烧,生成的CO2和H2O的物质的量之比为1:2,则( )
| A、分子中C、H、O个数之比为1:2:3 |
| B、分子中C、H个数之比为1:4 |
| C、分子中不可能含有氧原子 |
| D、此有机物的最简式为CH4 |
如图所示的装置最适宜于干燥、收集的气体是( )


| A、NO |
| B、HC1 |
| C、NO2 |
| D、NH3 |
NA表示阿伏加德罗常数的值,下列说法正确的是( )
| A、0.1 mol?L-1醋酸溶液中离子总数为0.2NA |
| B、T℃时,pH=6的纯水中,含10-8NA个OH- |
| C、25℃时,1L pH=13的氢氧化钠溶液中含有0.1NA氢氧根离子 |
| D、1L 0.1 mol?L-1的硫化钠溶液中硫离子数目为0.1NA |