题目内容
下列离子方程式表达正确的是( )
| A、向氯化铁溶液中滴加HI溶液:2Fe3++2HI=2Fe2++2H++I2 |
| B、1mol/L的NaAlO2溶液和2.5 mol/L的HCl等体积均匀混合:2AlO2-+5H+=Al(OH)3↓+Al3++H2O |
| C、向NaAlO2溶液中通入过量CO2制Al(OH)3:2AlO2-+CO2+3H2O=2Al(OH)3↓+CO32- |
| D、将16.8g 铁粉投入100mL 4.0mol/L的HNO3溶液中(还原产物只有NO)6Fe+20H-+5NO3-=3Fe2++3Fe3++5NO↑+10H2O |
考点:离子方程式的书写
专题:
分析:A.碘化氢为强电解质,应拆成离子形式;
B.偏铝酸根与氢离子反应,首先生成氢氧化铝,然后生成铝离子;
C.二者的物质的量比为2:5,1molAl(OH)3消耗3molH+,反应生成等量的铝离子、氢氧化铝;
D.16.8g 铁粉物质的量=
=0.3mol,100mL 4.0mol/L的HNO3溶液中含硝酸的物质的量=0.1L×4.0mol/L=0.4mol,依据3Fe+8HNO3═3Fe(NO3)2+2NO↑+4H2O,可知铁过量反应生成硝酸亚铁.
B.偏铝酸根与氢离子反应,首先生成氢氧化铝,然后生成铝离子;
C.二者的物质的量比为2:5,1molAl(OH)3消耗3molH+,反应生成等量的铝离子、氢氧化铝;
D.16.8g 铁粉物质的量=
| 16.8g |
| 56g/mol |
解答:
解:A.向氯化铁溶液中滴加HI溶液,离子方程式:2Fe3++2I-=2Fe2++I2,故A错误;
B.1mol/L的NaAlO2溶液和2.5 mol/L的HCl等体积均匀混合,二者的物质的量比为2:5,离子方程式:2AlO2-+5H+=Al(OH)3↓+Al3++H2O,故B正确;
C.向NaAlO2溶液中通入过量CO2制Al(OH)3,离子方程式:AlO2-+CO2+2H2O=Al(OH)3↓+HCO3-,故C错误;
D.将16.8g 铁粉投入100mL 4.0mol/L的HNO3溶液中(还原产物只有NO)铁粉过量,反应生成硝酸亚铁,离子方程式:3Fe+8H++2NO3-=3Fe2++2NO↑+4H2O,故D错误;
故选:B.
B.1mol/L的NaAlO2溶液和2.5 mol/L的HCl等体积均匀混合,二者的物质的量比为2:5,离子方程式:2AlO2-+5H+=Al(OH)3↓+Al3++H2O,故B正确;
C.向NaAlO2溶液中通入过量CO2制Al(OH)3,离子方程式:AlO2-+CO2+2H2O=Al(OH)3↓+HCO3-,故C错误;
D.将16.8g 铁粉投入100mL 4.0mol/L的HNO3溶液中(还原产物只有NO)铁粉过量,反应生成硝酸亚铁,离子方程式:3Fe+8H++2NO3-=3Fe2++2NO↑+4H2O,故D错误;
故选:B.
点评:本题考查了离子方程式的书写,题目难度不大,明确反应的实质是解题关键,注意反应物用量对反应的影响,选项BD为易错选项.

练习册系列答案
相关题目
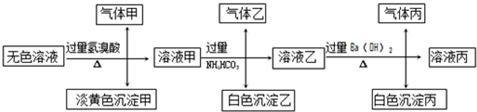
某无色溶液可能含有AgNO3、NaCl、Na2CO3和Na2SO4中的一种.取少量该溶液于试管中,加入稀盐酸,无明显现象,再加入BaCl2溶液,有白色沉淀产生.则该物质是( )
| A、AgNO3 |
| B、NaCl |
| C、Na2CO3 |
| D、Na2SO4 |
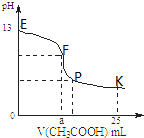 25℃时,在25mL0.1mol/L的NaOH溶液中逐渐滴加入0.2mol/L CH3COOH溶液,混合溶液pH的变化曲线如图所示,下列分析结论不正确的是( )
25℃时,在25mL0.1mol/L的NaOH溶液中逐渐滴加入0.2mol/L CH3COOH溶液,混合溶液pH的变化曲线如图所示,下列分析结论不正确的是( )| A、a=12.5,且混合溶液pH=7 |
| B、对应曲线上E、F间任何一点,溶液中都有:c(Na+)>c(CH3COO-)>c(OH-)>c(H+) |
| C、P点时,c(CH3COO-)>c(Na+)>c(H+)>c(OH-) |
| D、K点时,c(CH3COO-)+c(CH3COOH)=2c(Na+) |
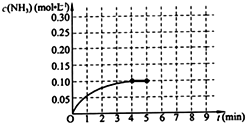 在一固定容积为2L的密闭容器内加入0.2mol的N2和0.6mol的H2,在一定条件下发生如下反应:N2(g)+3H2(g)?2NH3(g)△H<0.反应中NH3的物质的量浓度的变化情况如图所示,请回答下列问题:
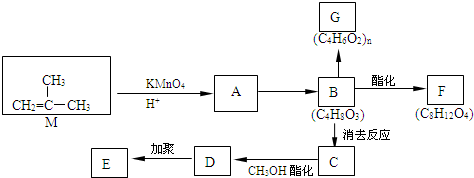
在一固定容积为2L的密闭容器内加入0.2mol的N2和0.6mol的H2,在一定条件下发生如下反应:N2(g)+3H2(g)?2NH3(g)△H<0.反应中NH3的物质的量浓度的变化情况如图所示,请回答下列问题: 结构的有机物可被酸性高锰酸钾溶液氧化成二元醇,如:CH2=CH2
结构的有机物可被酸性高锰酸钾溶液氧化成二元醇,如:CH2=CH2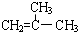 )为原料合成环状化合物F和高分子化合物E和G.
)为原料合成环状化合物F和高分子化合物E和G.