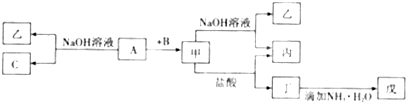
题目内容
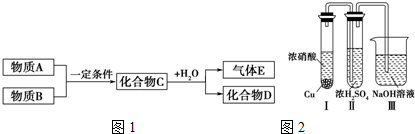
短周期元素形成的纯净物A、B、C、D、E,五种物质之间的转化关系如图1所示,物质A与物质B之间的反应不在溶液中进行(E可能与A、B两种物质中的一种相同).
请回答下列问题:
(1)若C是离子化合物,D是一种强碱,则C的化学式 ,并任写一种C的主要用途 .
(2)若E的水溶液呈弱酸性,D是既能溶于强酸、又能溶于强碱的化合物.
①用电离方程式解释D既能溶于强酸、又能溶于强碱的原因(仅写出电离方程式即可): .
②用电荷守恒的等式表示E与NaOH溶液反应生成正盐的溶液中所有离子的浓度之间的关系: .
(3)若C是一种气体,D是一种强酸,则:
①C与水反应的化学方程式为 .
②已知常温下物质A与物质B反应生成1mol气体C的△H=-57kJ?mol-1,1mol气体C与H2O反应生成化合物D和气体E的△H=-46kJ?mol-1,写出物质A与物质B及水反应生成化合物D的热化学方程式为 .
③有人认为“浓H2SO4可以干燥气体C”.某同学为了验证该观点是否正确,用如图2所示装置进行实验.
实验过程中,在浓H2SO4中未发现有气体逸出,则得出的结论是 .
④用铂做电极电解H2SO4的溶液,其阳极的电极反应式为 .

请回答下列问题:
(1)若C是离子化合物,D是一种强碱,则C的化学式
(2)若E的水溶液呈弱酸性,D是既能溶于强酸、又能溶于强碱的化合物.
①用电离方程式解释D既能溶于强酸、又能溶于强碱的原因(仅写出电离方程式即可):
②用电荷守恒的等式表示E与NaOH溶液反应生成正盐的溶液中所有离子的浓度之间的关系:
(3)若C是一种气体,D是一种强酸,则:
①C与水反应的化学方程式为
②已知常温下物质A与物质B反应生成1mol气体C的△H=-57kJ?mol-1,1mol气体C与H2O反应生成化合物D和气体E的△H=-46kJ?mol-1,写出物质A与物质B及水反应生成化合物D的热化学方程式为
③有人认为“浓H2SO4可以干燥气体C”.某同学为了验证该观点是否正确,用如图2所示装置进行实验.
实验过程中,在浓H2SO4中未发现有气体逸出,则得出的结论是
④用铂做电极电解H2SO4的溶液,其阳极的电极反应式为
考点:无机物的推断
专题:
分析:(1)若C是离子化合物,D是一种强碱,C为Na2O2,D为NaOH,E为O2,A、B分别为氧气、Na中的一种;
(2)若E的水溶液呈弱酸性,D是既能溶于强酸、又能溶于强碱的化合物,C为Al2S3,E为H2S,D为Al(OH)3,A、B分别为Al、S中的一种;
(3)若C是一种气体,D是一种强酸,C为NO2,D为HNO3,E为NO,据此解答.
(2)若E的水溶液呈弱酸性,D是既能溶于强酸、又能溶于强碱的化合物,C为Al2S3,E为H2S,D为Al(OH)3,A、B分别为Al、S中的一种;
(3)若C是一种气体,D是一种强酸,C为NO2,D为HNO3,E为NO,据此解答.
解答:
解:(1)若C是离子化合物,D是一种强碱,C为Na2O2,D为NaOH,E为O2,A、B分别为氧气、Na中的一种,过氧化钠可以用作供氧剂、漂白剂、氧化剂等,故答案为:Na2O2;供氧剂、漂白剂、氧化剂;
(2)若E的水溶液呈弱酸性,D是既能溶于强酸、又能溶于强碱的化合物,C为Al2S3,E为H2S,D为Al(OH)3,A、B分别为Al、S中的一种,则:
①用电离方程式解释D既能溶于强酸、又能溶于强碱的原因:H++H2O+AlO2-═Al(OH)3═Al3++3OH-,故答案为:H++H2O+AlO2-═Al(OH)3═Al3++3OH-;
②H2S与NaOH溶液反应生成正盐为Na2S,溶液中硫离子水解,用电荷守恒的等式表示溶液中所有离子的浓度之间的关系为:c(Na+)+c(H+)═2c(S2-)+c(HS-)+c(OH-),故答案为:c(Na+)+c(H+)═2c(S2-)+c(HS-)+c(OH-);
(3)若C是一种气体,D是一种强酸,C为NO2,D为HNO3,E为NO,则:
①C与水反应的化学方程式为:3NO2+H2O═2HNO3+NO,故答案为:3NO2+H2O═2HNO3+NO;
②常温下物质A与物质B生成1mol气体C的△H为-57kJ?mol-1,则:
反应的热化学方程式为:①2NO(g)+O2(g)=2NO2(g)△H=-114kJ?mol-1,
1mol气体C与H2O反应生成D溶液和E气体的△H为-46kJ?mol-1,
反应的热化学方程式为:②3NO2(g)+H2O(l)=2HNO3(aq)+NO(g);△H=-138 kJ?mol-1,
则①×3+②×2得4NO(g)+3O2(g)+2H2O(1)=4HNO3 (aq);△H=3×(114kJ?mol-1)+2×(-138 kJ?mol-1)=-618kJ?mol-1,
故答案为:4NO(g)+3O2(g)+2H2O(1)=4HNO3 (aq)△H=-618kJ?mol-1;
③由现象实验过程中,浓H2SO4中未发现有气体逸出,可以得出NO2能溶于浓硫酸中,故答案为:NO2能溶于浓H2SO4,因而不能用浓H2SO4干燥NO2;
④用铂做电极电解H2SO4的溶液,阳极发生氧化反应,氢氧根离子在阳极放电生成氧气,其阳极的电极反应式为:4OH--4e-═O2↑+2H2O,故答案为:4OH--4e-═O2↑+2H2O.
(2)若E的水溶液呈弱酸性,D是既能溶于强酸、又能溶于强碱的化合物,C为Al2S3,E为H2S,D为Al(OH)3,A、B分别为Al、S中的一种,则:
①用电离方程式解释D既能溶于强酸、又能溶于强碱的原因:H++H2O+AlO2-═Al(OH)3═Al3++3OH-,故答案为:H++H2O+AlO2-═Al(OH)3═Al3++3OH-;
②H2S与NaOH溶液反应生成正盐为Na2S,溶液中硫离子水解,用电荷守恒的等式表示溶液中所有离子的浓度之间的关系为:c(Na+)+c(H+)═2c(S2-)+c(HS-)+c(OH-),故答案为:c(Na+)+c(H+)═2c(S2-)+c(HS-)+c(OH-);
(3)若C是一种气体,D是一种强酸,C为NO2,D为HNO3,E为NO,则:
①C与水反应的化学方程式为:3NO2+H2O═2HNO3+NO,故答案为:3NO2+H2O═2HNO3+NO;
②常温下物质A与物质B生成1mol气体C的△H为-57kJ?mol-1,则:
反应的热化学方程式为:①2NO(g)+O2(g)=2NO2(g)△H=-114kJ?mol-1,
1mol气体C与H2O反应生成D溶液和E气体的△H为-46kJ?mol-1,
反应的热化学方程式为:②3NO2(g)+H2O(l)=2HNO3(aq)+NO(g);△H=-138 kJ?mol-1,
则①×3+②×2得4NO(g)+3O2(g)+2H2O(1)=4HNO3 (aq);△H=3×(114kJ?mol-1)+2×(-138 kJ?mol-1)=-618kJ?mol-1,
故答案为:4NO(g)+3O2(g)+2H2O(1)=4HNO3 (aq)△H=-618kJ?mol-1;
③由现象实验过程中,浓H2SO4中未发现有气体逸出,可以得出NO2能溶于浓硫酸中,故答案为:NO2能溶于浓H2SO4,因而不能用浓H2SO4干燥NO2;
④用铂做电极电解H2SO4的溶液,阳极发生氧化反应,氢氧根离子在阳极放电生成氧气,其阳极的电极反应式为:4OH--4e-═O2↑+2H2O,故答案为:4OH--4e-═O2↑+2H2O.
点评:本题考查无机物的推断,属于开放性题目,需要学生熟练掌握元素化合物知识,题目难度中等.

练习册系列答案
相关题目
下列各化学式中,只表示一种纯净物的是( )
| A、C2H3Br |
| B、C3H6 |
| C、C2H4O |
| D、C |
下列性质的比较正确的是( )
| A、酸性:H2SiO3>H2CO3 |
| B、碱性:Mg(OH)2>Al(OH)3 |
| C、稳定性:SiH4>PH3 |
| D、原子半径:N>C |
某温度下,已知反应mX(g)+nY(g)?qZ(g)△H>0,m+n>q,在体积一定的密闭容器中投入反应物达到平衡,下列叙述正确的是( )
| A、通惰性气体增大压强,平衡正向移动 | ||
| B、再加入X,反应吸收的热量增大 | ||
| C、增加Y的物质的量,X的转化率减小 | ||
D、降低温度,
|
0.5mol CH4完全燃烧生成CO2和液态H2O时,放出445kJ的热量,则下列热化学方程式中正确的是( )
| A、CH4(g)+2O2(g)=CO2(g)+4H2O(g)△H=-890 kJ/mol | ||||
| B、CH4(g)+2O2(g)=CO2(g)+2H2O(l)△H=+890 kJ/mol | ||||
| C、CH4(g)+2O2(g)=CO2(g)+2H2O(l)△H=-890 kJ/mol | ||||
D、
|
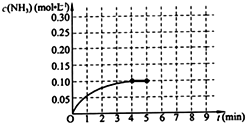 在一固定容积为2L的密闭容器内加入0.2mol的N2和0.6mol的H2,在一定条件下发生如下反应:N2(g)+3H2(g)?2NH3(g)△H<0.反应中NH3的物质的量浓度的变化情况如图所示,请回答下列问题:
在一固定容积为2L的密闭容器内加入0.2mol的N2和0.6mol的H2,在一定条件下发生如下反应:N2(g)+3H2(g)?2NH3(g)△H<0.反应中NH3的物质的量浓度的变化情况如图所示,请回答下列问题: 写出下列反应的化学方程式
写出下列反应的化学方程式