题目内容
NA表示阿伏加德罗常数的值,下列说法正确的是( )
| A、0.1 mol?L-1醋酸溶液中离子总数为0.2NA |
| B、T℃时,pH=6的纯水中,含10-8NA个OH- |
| C、25℃时,1L pH=13的氢氧化钠溶液中含有0.1NA氢氧根离子 |
| D、1L 0.1 mol?L-1的硫化钠溶液中硫离子数目为0.1NA |
考点:阿伏加德罗常数
专题:阿伏加德罗常数和阿伏加德罗定律
分析:A、醋酸是弱电解质,部分电离;
B、纯水电离出的氢离子浓度等于氢氧根的浓度;
C、根据pH计算氢离子浓度,再根据水的离子积计算氢氧根离子浓度,再由体积计算氢氧根个数;
D、依据盐类水解解答即可.
B、纯水电离出的氢离子浓度等于氢氧根的浓度;
C、根据pH计算氢离子浓度,再根据水的离子积计算氢氧根离子浓度,再由体积计算氢氧根个数;
D、依据盐类水解解答即可.
解答:
解:A、0.1mol/L的醋酸溶液中溶质物质的量不能确定是0.1mol,且醋酸是弱电解质部分电离,故A错误;
B、纯水中氢离子浓度等于氢氧根浓度,但是体积不能确定是多少,故无法计算氢氧根的个数,故B错误;
C、pH=13的氢氧化钠溶液中,氢离子浓度为10-13mol/L,氢氧根离子浓度为:
=0.1mol/L,1L溶液中含氢氧根离子个数为0.1NA,故C正确;
D、硫离子为弱酸根离子,在水中水解,故数目小于0.1mol,故D错误,
故选C.
B、纯水中氢离子浓度等于氢氧根浓度,但是体积不能确定是多少,故无法计算氢氧根的个数,故B错误;
C、pH=13的氢氧化钠溶液中,氢离子浓度为10-13mol/L,氢氧根离子浓度为:
| 1×10-14 |
| 10-13 |
D、硫离子为弱酸根离子,在水中水解,故数目小于0.1mol,故D错误,
故选C.
点评:本题主要考查的是盐类水解、水的离子积等,属于常考题,注意总结规律.

练习册系列答案
 导学与测试系列答案
导学与测试系列答案 新非凡教辅冲刺100分系列答案
新非凡教辅冲刺100分系列答案
相关题目
药物贝诺酯可由乙酰水杨酸和对乙酰氨基酚在一定条件下反应制得:下列有关叙述不正确的是( )
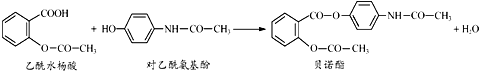

| A、贝诺酯分子中有两种含氧官能团 |
| B、可用FeCl3溶液区别乙酰水杨酸和对乙酰氨基酚 |
| C、乙酰水杨酸和对乙酰氨基酚均能与Na2CO3溶液反应 |
| D、贝诺酯与足量NaOH溶液共热,最终生成乙酰水杨酸钠和对乙酰氨基酚钠 |
下列反应是工业生产硝酸的一个反应过程,4NH3(g)+5O2(g)?4NO(g)+6H2O(g)△H=-1025kJ/mol,若反应物起始的物质的量相同.下列关于该反应的示意图不正确的是( )
A、 |
B、 |
C、 |
D、 |
如图甲池和乙池中的四个电极都是惰性材料,请根据图示判断下列说法正确的是( )


| A、甲池中,b电极是负极 |
| B、a电极的电极反应式C2H5OH+16OH--12e-=2CO32-+11H2O |
| C、一段时间后,用湿润淀粉KI试纸靠近乙池d电极变蓝放电 |
| D、乙池在反应前后溶液的pH不变 |
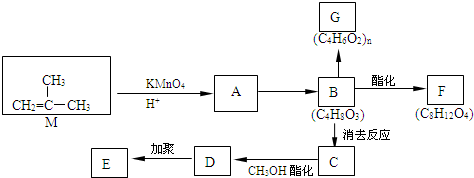
 结构的有机物可被酸性高锰酸钾溶液氧化成二元醇,如:CH2=CH2
结构的有机物可被酸性高锰酸钾溶液氧化成二元醇,如:CH2=CH2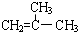 )为原料合成环状化合物F和高分子化合物E和G.
)为原料合成环状化合物F和高分子化合物E和G.