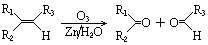题目内容
10.下列说法正确的是( )| A. | 常温下,反应C(s)+CO2(g)=2CO(g)不能自发进行,则该反应的△H>0 | |
| B. | 已知2CO(g)+O2(g)=2CO2(g)△H=-566 kJ•mol-1,则CO的燃烧热△H=-283 kJ | |
| C. | 已知H+(aq)+OH-(aq)=H2O(l)△H=-57.3 kJ•mol-1,则稀H2SO4溶液和稀Ba(OH)2溶液反应的反应热△H═2×(-57.3)kJ•mol-1 | |
| D. | 500℃、30MPa下,将0.5mol N2和1.5molH2置于密闭的容器中充分反应生成NH3(g),放热19.3kJ,热化学方程式为:N2(g)+3H2(g)$?_{500℃/30Mpa}^{催化剂}$ 2NH3(g)△H=-38.6 kJ•mol-1 |
分析 A.该反应的△S=0,△H-T△S<0的反应可自发进行;
B.1molCO燃烧生成稳定氧化物的能量为燃烧热,焓变的单位为kJ/mol;
C.物质的量与热量成正比,且生成硫酸钡放热;
D.合成氨为可逆反应,热化学方程式中为完全转化的能量变化.
解答 解:A.该反应的△S=0,△H-T△S<0的反应可自发进行,则C(s)+CO2(g)=2CO(g)不能自发进行,可知该反应的△H>0,故A正确;
B.1molCO燃烧生成稳定氧化物的能量为燃烧热,由热化学方程式可知CO的燃烧热△H=-283 kJ/mol,故B错误;
C.物质的量与热量成正比,且生成硫酸钡放热,由中和热及焓变为负,可知稀H2SO4溶液和稀Ba(OH)2溶液反应生成2mol水的反应热△H<2×(-57.3)kJ•mol-1,故C错误;
D.合成氨为可逆反应,热化学方程式中为完全转化的能量变化,且为放热反应,焓变为负,则N2(g)+3H2(g)$?_{500℃/30Mpa}^{催化剂}$ 2NH3(g)△H<-38.6 kJ•mol-1,故D错误;
故选A.
点评 本题考查反应热与焓变,为高频考点,把握反应中能量变化、燃烧热与中和热,焓变为解答的关键,侧重分析与应用能力的考查,注意焓变的正负,题目难度不大.

练习册系列答案
相关题目
1.一定条件下,在密闭恒容的容器中,发生如下反应:3A(g)+2B(g)+6C(g)$\frac{\underline{\;高温\;}}{\;}$M(s)+12N (g),不能表示上述反应达到化学平衡状态的是( )
| A. | 3v逆(B)=v正(C) | B. | 容器内压强不再改变 | ||
| C. | 混合气体密度保持不变 | D. | c(B):c(C):c(N)=1:3:6 |
1.下列条件下,两种气体分子数一定不相等的是( )
| A. | 相同质量、不同密度的N2O和CO2 | |
| B. | 相同体积、相同密度的N2和C2H4 | |
| C. | 相同温度、相同压强、相同体积的NO2和N2O4 | |
| D. | 相同压强、相同体积、相同质量的O2和O3 |
5.下列不能用勒夏特列原理解释的是( )
| A. | 热的纯碱溶液去油污效果好 | |
| B. | 新制的氯水在光照条件下颜色变浅 | |
| C. | 收集氯气用排饱和食盐水的方法 | |
| D. | 500℃左右比室温更有利于合成氨的反应 |
15.下列各组物质中,碳氢两种元素的质量比是一个定值的是( )
| A. | CH4、C2H4 | B. | C2H4、C4H8 | C. | C2H6、C2H2 | D. | C2H4、C2H2 |
19.下列说法正确的是( )
| A. | 能自发进行的反应一定能迅速发生 | |
| B. | 反应NH4HCO3(s)=NH3(g)+H2O(g)+CO2(g)△H=+185.57 kJ•mol-1能自发进行,是因为体系有自发地向混乱度增大的方向转变的倾向 | |
| C. | 因为焓变和熵变都与反应的自发性有关,因此焓变或熵变均可以单独作为判断反应能否自发进行的判据 | |
| D. | 在其他外界条件不变的情况下,使用催化剂,可以改变化学反应进行的方向 |
20.下列反应的离子方程式书写正确的是( )
| A. | 氯气溶于水:Cl2+H2O═Cl-+ClO-+2H+ | |
| B. | 金属钠加入稀硫酸中:Na+2H+═Na++H2↑ | |
| C. | 明矾溶液中加入足量Ba(OH)2溶液:SO42-+Al3++Ba2++4OH-═AlO2-+BaSO4↓+2H2O | |
| D. | 向含有稀盐酸的氯化亚铁溶液中通入氧气:4Fe2++O2+4H+═4 Fe3++2H2O |
 .
.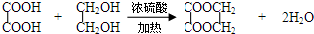 .
.